Protokół wyszukiwania i przegląd literatury dotyczącej urządzeń medycznych - przegląd
W skomplikowanej dziedzinie wyroby medyczne diagnostyki in vitro (IVD) znaczenie dobrze skonstruowanego protokołu wyszukiwania literatury dotyczącej wyrobów medycznych i jej przeglądu wykracza poza zwykłe badania naukowe. Staje się on podstawą do osiągnięcia zgodności z rygorystycznymi wymogami bezpieczeństwa i wydajności określonymi w przepisach, takich jak rozporządzenie Unii Europejskiej w sprawie wyrobów medycznych (EU MDR) 2017/745 i rozporządzenie Unii Europejskiej w sprawie diagnostyki in vitro (EU IVDR) 2017/746.
Przegląd literatury na EU MDR
Przegląd literatury odgrywa kluczową rolę w zarządzaniu cyklem życia wyrobu medycznego. Systematyczna strategia wyszukiwania literatury EU MDR jest podstawą sukcesu oceny klinicznej, oceny działania, a nawet nadzoru po wprowadzeniu do obrotu i raportów z badań klinicznych/działania po wprowadzeniu do obrotu. Niniejszy przegląd, oparty na strategii systematycznego przeszukiwania literatury, jest nie tylko etapem, ale także drogowskazem w kierunku świadomego podejmowania decyzji.
Siła solidnego zespołu ds. syntezy literatury naukowej
Producenci poruszający się w skomplikowanej dziedzinie wyroby medyczne wyrobów do diagnostyki in vitro potrzebują czegoś więcej niż tylko rutynowego przeglądu literatury. Solidny zespół zajmujący się syntezą literatury naukowej, posiadający dogłębną wiedzę w zakresie terapii, jest kompasem, który prowadzi ich przez labirynt wymagań regulacyjnych, zapewniając nie tylko zgodność z przepisami, ale wręcz ich przewyższenie.
Protokół wyszukiwania literatury EU MDR
Następujące etapy składają się na proces przeszukiwania literatury EU MDR :
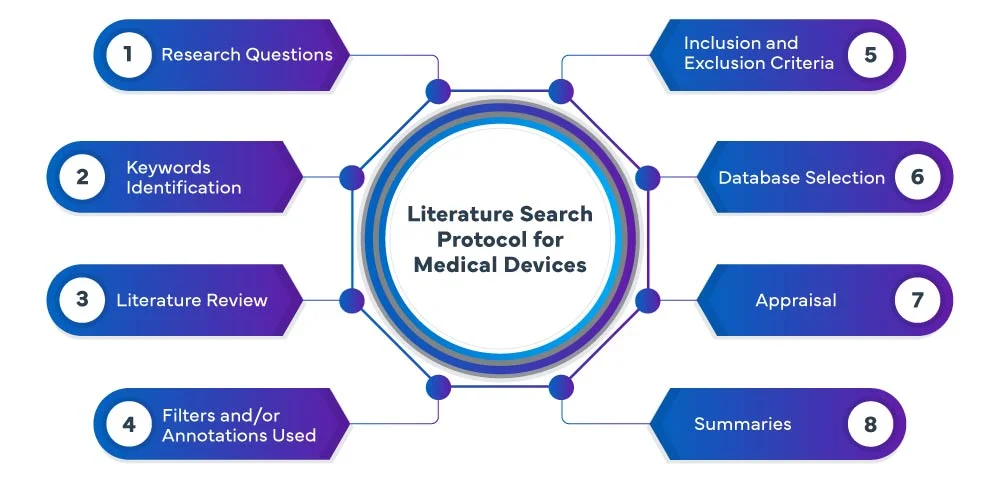
W Freyr przeprowadzamy systematyczne i wyczerpujące wyszukiwanie literatury na temat urządzeń medycznych w różnych bazach danych, w tym PubMed, Embase i Cochrane, aby zidentyfikować odpowiednie badania i publikacje związane z danym urządzeniem medycznym. Nasz zespół wykorzystuje zaawansowane strategie wyszukiwania, aby upewnić się, że wychwytujemy wszystkie istotne dowody. Skrupulatnie analizujemy i podsumowujemy wyniki, dostarczając kompleksowy przegląd, który służy jako podstawa procesu rozwoju lub oceny urządzenia.
Zdajemy sobie sprawę, że każde urządzenie medyczne jest wyjątkowe, a każda kategoria produktów wymaga dostosowanych rozwiązań. Ściśle współpracujemy z klientami, aby zrozumieć ich wymagania i zapewnić dostosowane usługi, które skutecznie spełnią ich cele.
Protokół wyszukiwania i przegląd literatury dotyczącej urządzeń medycznych
- Identyfikacja, wyszukiwanie, analiza i zestawianie odpowiedniej literatury naukowej.
- Strategizowanie ciągów wyszukiwania i włączanie/wyłączanie kryteriów.
- Identyfikacja odpowiedniej bazy danych dla raportu z wyszukiwania literatury, zgodnie z wymaganiami.
- Zestawienie danych literaturowych.
- Przegląd odpowiedniej literatury.
- Integracja danych PMS (jeśli dotyczy).
- Dokumentowanie i raportowanie.
- Utworzenie Clinical Evaluation Report (CER)) zgodnie z przepisami EU MDR 2017/745.
- Tworzenie Clinical Evaluation Plan (CEP) dla organizacji.
- Przeprowadzenie oceny luk w istniejących CEP.

- Zapewnienie zgodności z najnowszymi obowiązującymi przepisami.
- Zespół wykwalifikowanych ekspertów klinicznych.
- Skalowalność zespołu.
- Rozwiązania dostosowane do Twoich wymagań.
- Wielofunkcyjny wkład ekspertów w dziedzinie urządzeń medycznych w celu spełnienia wymagań.
- Pełny zakres usług od zgodności, przeglądu i planowania.


