Naukowy Raport Ważności (SVR) Przegląd
Raport o ważności naukowej (SVR) ma ogromne znaczenie w raporcie oceny wydajności (PER) dla wyrobów medycznych do diagnostyki in vitro (IVD), zgodnie z rozporządzeniem Unii Europejskiej w sprawie wyrobów medycznych do diagnostyki in vitro (EU IVDR) 2017/746. SVR odgrywa kluczową rolę w naukowej walidacji wydajności analitycznej i klinicznej wyrobu, zapewniając bezpieczeństwo i skuteczność wyroby medyczne na rynku. W ramach procesu oceny zgodności określonego w rozporządzeniu UE IVDR producenci są zobowiązani do przedstawienia organowi notyfikowanemu raportu PER, który musi zawierać raport SVR, w celu wykazania bezpieczeństwa i wydajności wyrobu przed wprowadzeniem go na rynek UE.
Raporty o ważności naukowej na potrzeby przedłożenia EU IVDR
- Analiza i wnioski
Co składa się na treść raportu naukowego (SVR)?
Ważność naukowa analitu oznacza powiązanie analitu ze stanem klinicznym lub fizjologicznym. Ważność naukowa IVD opiera się głównie na jednym lub kombinacji następujących źródeł:
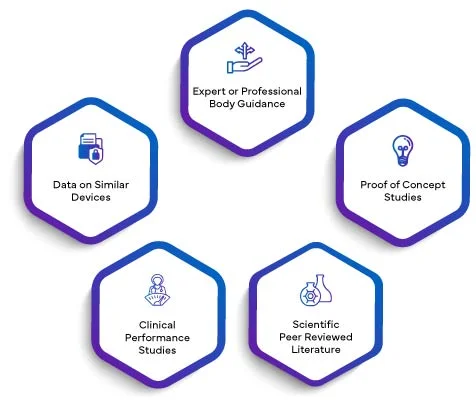
Dane ze wszystkich powyższych, w stosownych przypadkach, zostaną opracowane w raporcie naukowym. Włączając SVR do PER, producenci podnoszą swoją ocenę wydajności na wyższy poziom wiarygodności. Ważność naukowa ustalona za pomocą SVR nadaje PER solidne podstawy, podnosząc jego ogólną jakość i znaczenie. To z kolei wzbudza zaufanie organów regulacyjnych, pracowników służby zdrowia i użytkowników końcowych, zapewniając, że działanie IVD jest skrupulatnie oceniane i walidowane zgodnie z rygorystycznymi wymogami UE IVDR 2017/746.
Freyr oferuje kompleksową pomoc w przygotowaniu solidnego raportu ważności naukowej (SVR) dla urządzeń IVD, umożliwiając pewne poruszanie się w środowisku regulacyjnym i płynne wprowadzanie na rynek bezpiecznych i skutecznych urządzeń IVD.
Raport dotyczący ważności naukowej
- Plan przejścia na zgodność z IVDR.
- Scientific Validity Report (SVR) w oparciu o literaturę i/lub dane wewnętrzne.
- Raporty wydajności klinicznej (CPR) oparte na literaturze i/lub danych wewnętrznych.
- Analityczne raporty wydajności (APR)
- Dowody kliniczne lub raporty z oceny wydajności zgodnie z IVDR.
- Plan oceny wyników.
- Protokoły i raporty PMPF (Post Market Performance Follow Up).
- Protokoły i raporty z nadzoru pozarynkowego (PMSR).
- Pisanie/opracowywanie innych dokumentów, takich jak ulotka dołączana do opakowania/IFU, skrócona instrukcja obsługi (QRI), instrukcja obsługi/użytkownika itp.

- Zapewnienie zgodności z najnowszymi obowiązującymi przepisami.
- Zespół wykwalifikowanych ekspertów
- Rozwiązania dostosowane do wymagań klienta
- Zarządzanie zasobami regulacyjnymi/usługi zwiększania personelu
- Wielofunkcyjny wkład ekspertów ds. urządzeń medycznych w celu spełnienia wymagań.