
Un schéma thérapeutique comprend divers médicaments dont l'utilisation peut être approuvée en association avec un médicament déjà approuvé ou avec deux nouveaux médicaments développés simultanément, qui améliorent l'efficacité de manière synergique. Les thérapies anticancéreuses à médicament unique ont mis en évidence la résistance aux médicaments comme une menace majeure pour les patients traités avec des médicaments anticancéreux. Compte tenu de la diversité des combinaisons thérapeutiques adoptées pour le traitement du cancer, les régimes à deux médicaments remplacent progressivement la monothérapie en tant que norme de soins pour les patients. Au cours de la décennie, la thérapie combinée a permis d'améliorer les possibilités de traitement.
Si vous êtes une organisation consciente du changement de paradigme dans le développement des médicaments anticancéreux, qui est passé du développement de médicaments uniques à celui de combinaisons novatrices, vous savez certainement que cette avancée a entraîné une augmentation des demandes d'autorisation de mention croisée de la part des demandeurs. En tenant compte des discussions, des dernières tendances du secteur et de sa compréhension actuelle des exigences des promoteurs, la US and Drug Administration (USFDA) US a publié une série de lignes directrices visant à faciliter les modifications d'étiquetage pour les schémas thérapeutiques comprenant des médicaments déjà approuvés.
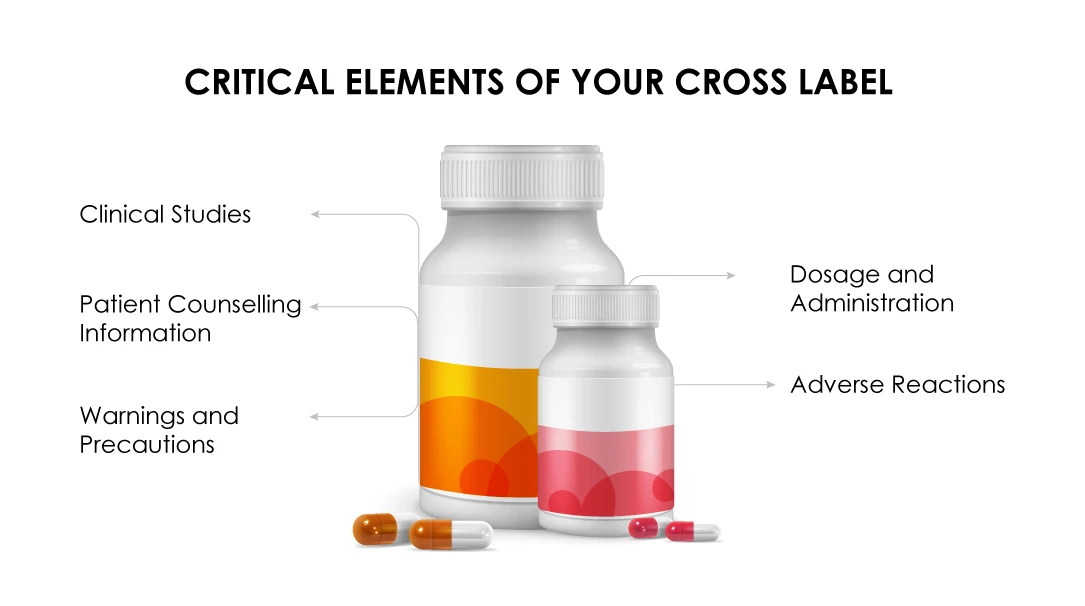
Félicitations ! Votre demande de conseils en matière d'étiquetage croisé a été acceptée, si :
(a) L'indication de la combinaison thérapeutique demandée est approuvée dans le cadre d'une indication médicamenteuse similaire.
(b) La section " Posologie et administration" doit mettre en évidence la posologie recommandée pour le médicament du promoteur dans le cadre d'un traitement combiné.
(c) Les données de l'étude clinique doivent justifier les avantages de l'association pour tous les médicaments du régime.
(d) La section "Avertissementset précautions " doit mentionner le caractère unique du régime combiné sur la base de données cliniquement significatives.
(e) Les effets indésirables doivent être mis en évidence tels qu'ils ont été observés dans les essais cliniques.
(f) Lanotice d'information destinée au patient doit se limiter aux toxicités propres à la formulation.
Les informations relatives au seul médicament du promoteur doivent occuper les autres sections de l'étiquette, à moins que des facteurs pharmacocinétiques uniques ne doivent être mentionnés.
Les lignes directrices approuvées pour l'étiquetage croisé ciblent spécifiquement les produits thérapeutiques anticancéreux afin d'énoncer les principes fondamentaux de l'étiquetage croisé. Pour aider les promoteurs à surmonter les obstacles opérationnels et réglementaires liés à la modification de l'étiquetage, les lignes directrices précisent ce qui suit :
- Calendrier
Les demandeurs doivent proposer le contenu provisoire de l'étiquetage croisé, accompagné d'une justification fondée sur des preuves du rôle de chaque produit mentionné dans le traitement, dans leur proposition d'étiquetage croisé d'un nouveau médicament anticancéreux dans une BLA NDA BLA .
L'étiquetage croisé devrait être identifié pour chaque médicament du régime en même temps. Toutefois, l'approbation peut être accordée l'une après l'autre, dans une séquence, en raison de la différence dans le calendrier du médicament.
- Soumission réglementaire
Chaque demandeur souhaitant obtenir un label croisé doit déposer une demande originale ou un supplément d'efficacité pour le label croisé.
Un demandeur peut choisir de faire référence aux données d'autres demandes pour justifier les avantages synergiques du régime combiné.
Lors du référencement des données, le demandeur :
- doit s'assurer que les données référencées ont déjà été déposées auprès de la FDA.
- doit annoter chaque section des données du demandeur faisant l'objet d'une référence croisée.
- ne doit inclure (section ci-dessous) que les informations relatives à la drogue du candidat :
- AVERTISSEMENT ENCADRÉ (le cas échéant)
- FORMES DE DOSAGE ET CONCENTRATIONS
- CONTRE-INDICATIONS
- LES INTERACTIONS MÉDICAMENTEUSES
- UTILISATION DANS DES POPULATIONS SPÉCIFIQUES
- SURDOSAGE
- DESCRIPTION
- LA PHARMACOLOGIE CLINIQUE
- TOXICOLOGIE NON CLINIQUE
- RÉFÉRENCES
- MODE DE FOURNITURE/STOCKAGE ET MANIPULATION
Le cross-labeling des médicaments anticancéreux peut aider à informer les patients sur la posologie, l'efficacité et les avantages des résultats thérapeutiques. Avec l'augmentation exponentielle des traitements combinés comme méthode standard, le cross-labeling peut s'avérer bénéfique pour l'amélioration ou l'introduction des méthodes thérapeutiques actuelles. Les experts chevronnés de Freyr bien les défis liés à l'étiquetage dynamique et peuvent vous fournir des solutions à vos questions en matière d'étiquetage. Bénéficiez d'un soutien professionnel de premier ordre en matière d'étiquetage. Contactez Freyr!









