
Une communication efficace a toujours garanti la sécurité et la qualité des soins prodigués aux patients. Au fil des ans, le besoin de fournir des traductions des étiquettes aux personnes qui ne maîtrisent pas l'anglais est resté insatisfait. La demande d'étiquettes de produits dans plusieurs langues régionales a connu une croissance exponentielle, les fabricants pharmaceutiques souhaitant s'orienter vers la localisation et une meilleure communication.
Répondre à ces demandes améliorera la sécurité des patients tout en permettant de se conformer aux exigences réglementaires spécifiques à chaque pays. L'absence d'informations médicales importantes dans les textes régionaux impose aux pharmaciens et aux professionnels de la santé une charge supplémentaire pour surmonter la barrière de la langue.
L'autorité de réglementation des produits de santé (HPRA) veille au respect de la réglementation en Irlande. La HPRA facilite et travaille conjointement avec les parties prenantes en adhérant au guide des meilleures pratiques sur l'étiquetage multilingue publié par le Groupe de coordination pour la reconnaissance mutuelle et les procédures décentralisées - humain (CMDh). En outre, la HPRA a également assoupli certaines conditions d'étiquetage, notamment :
- Utilisation du mL Irlande (IE) par rapport ml les autres États membres de l'UE.
- Utilisation de points décimaux dans le volume ou le dosage du produit et d'un point en IE contre une virgule dans l'UE. Les fabricants de médicaments peuvent surmonter cette divergence en regroupant le nom de fantaisie, le dosage et la forme du médicament en une seule unité dans chaque langue.
- Utilisation du séparateur dans le dosage ou le volume du produit - Un point dans l'UE contre une virgule dans l'IE. L'utilisation de la virgule comme séparateur est autorisée sur l'emballage extérieur immédiat afin d'éviter tout risque de confusion dans la population irlandaise.
- Les petites unités de conditionnement primaire, c'est-à-dire les récipients d'une taille inférieure ou égale à 50 ml, ont une contrainte d'espace et peuvent contenir les informations minimales requises, lorsque cela se justifie, dans plus de deux (02) langues.
- Informations sur les pays tiers - lorsque les conditions d'information sur le produit sont similaires au Royaume-Uni et en Irlande, les emballages multi-pays sont acceptés. Les exigences supplémentaires spécifiques à un pays sont placées dans une "boîte bleue".
- Coordination de l'évaluation avec les autres Member States Des évaluations simulées réalisées par les Member States Conformité du labelling. Les demandeurs peuvent se coordonner avec les Member States obtenir des précisions sur les modifications requises avant de soumettre leur demande à la HPRA.
- Noms communs - La mise en avant du nom inventé Member States être signalée à la HPRA.
L'ARPS propose des suggestions supplémentaires pour l'étiquetage multilingue :
- Les informations mentionnées en anglais doivent être regroupées dans un bloc.
- Mentionner les exigences de la "boîte bleue" pour tous les pays sur le même panneau lorsque plusieurs pays partagent un même paquet.
- Les informations destinées aux patients irlandais doivent être clairement indiquées dans un code ovale.
- Les demandeurs peuvent inclure une section perforée sur l'emballage, à condition que les données amovibles ne soient pas en anglais. Cela doit être mentionné dans la soumission.
- Les demandeurs doivent soumettre un PDF de la notice à l'ARPS à la fin de la procédure pour qu'elle soit mise à jour sur le site web.
Critères pour un paquet multilingue :
- Le nom du produit et sa puissance doivent être identiques dans toutes les langues.
- Les informations figurant sur l'étiquetage et la notice doivent être conformes au résumé des caractéristiques du produit (SmPC).
- Les informations imprimées sur l'étiquetage et la notice doivent être exactes et lisibles.
- Le statut juridique du médicament doit être similaire dans les deux pays.
Voici un exemple d'emballage multilingue :
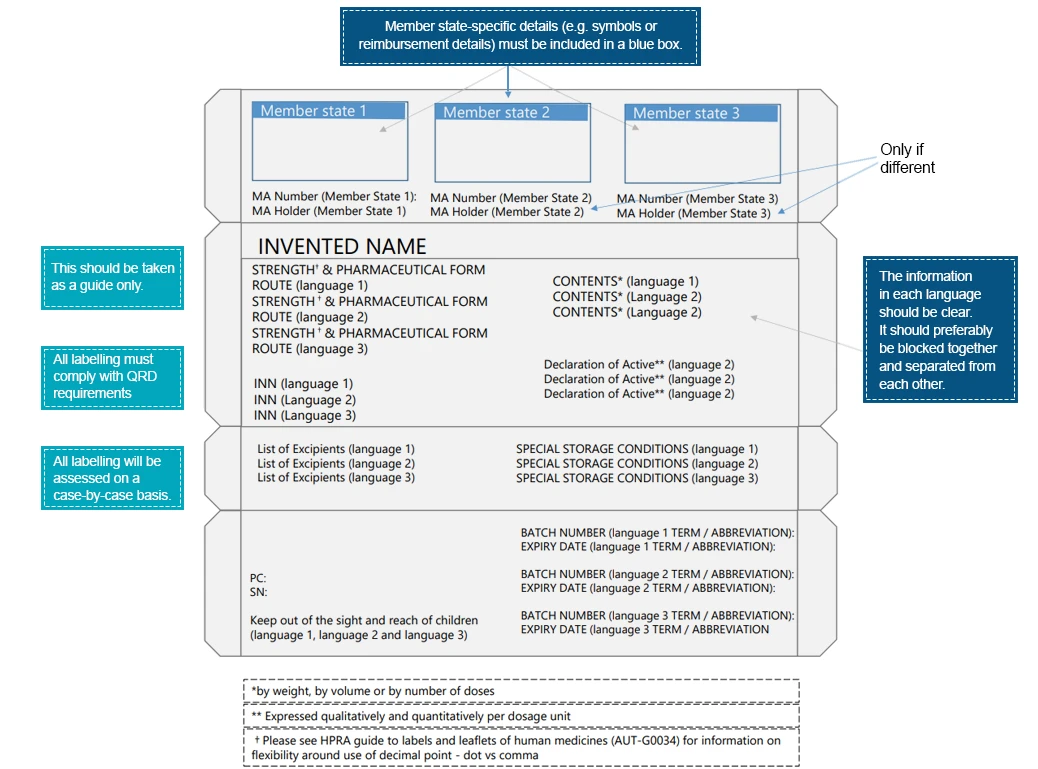
Les patients interagissent avec les étiquettes des médicaments bien avant d'interagir avec le produit pharmaceutique lui-même. Ces interactions soulignent encore davantage l'importance de transmettre les informations essentielles à travers les différents éléments de l'étiquette du médicament. Afin d'assurer une meilleure lisibilité et une amélioration des éléments de l'étiquette, les entreprises pharmaceutiques doivent prendre les mesures nécessaires. Les langues régionales constituent un moyen de transmettre les instructions médicales relatives au médicament, qui garantissent une utilisation sûre et efficace du produit prescrit. Des experts en réglementation spécifiques à chaque pays peuvent aider à traduire les informations figurant sur les étiquettes conformément aux réglementations locales/régionales.Les experts Freyr sont parfaitement équipés pour aider à combler le fossé entre les informations médicales et la langue. us une procédure d'étiquetage conforme.









