
Les produits combinés ou les produits qui associent des médicaments, des dispositifs ou des produits biologiques posent des problèmes particuliers en matière d'étiquetage réglementaire. Comme ces produits sont constitués de composants multiples et de normes réglementaires différentes, les fabricants doivent s'assurer qu'ils respectent toutes les exigences individuelles et qu'ils transmettent correctement les informations relatives à la sécurité.
Ce blog explore les défis de l'étiquetage des produits combinés et fournit des stratégies pour naviguer dans les exigences réglementaires en matière d'étiquetage tout en donnant la priorité à la sécurité des patients et à la conformité. La figure 1 ci-dessous met en évidence les principaux défis liés à l'étiquetage des produits combinés.
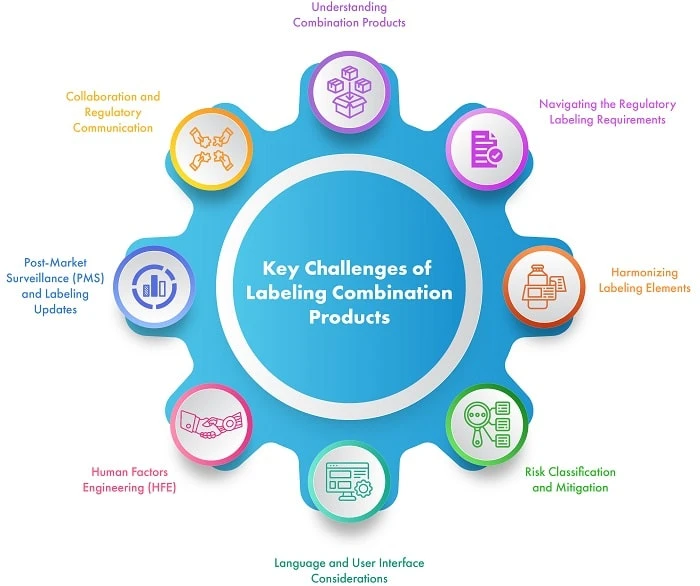
Figure 1 : Principaux défis liés à l'étiquetage des produits combinés
Examinons us chaque défi en détail :
- Comprendre les produits combinés : Les produits combinés associent divers composants, par exemple un produit composé d'un médicament et d'un dispositif, afin d'offrir des choix de traitement innovants. Cependant, la convergence de différents cadres et exigences réglementaires peut compliquer leur processus d'étiquetage. Il est donc essentiel de reconnaître la méthode fondamentale de fonctionnement et les réglementations pertinentes pour chaque composant.
- Naviguer parmi les exigences réglementaires en matière d'étiquetage : les produits combinés doivent respecter à la fois les lois sur les médicaments et celles sur les dispositifs médicaux, ce qui nécessite de naviguer parmi plusieurs voies réglementaires. Collaborez étroitement avec des experts en affaires réglementaires afin de comprendre et de respecter les exigences spécifiques en matière d'étiquetage établies par des agences telles que la Food and Drug Administration (USFDA) des États-Unis, l'Agence européenne des médicaments (EMA) et d'autres autorités compétentes.
- Harmonisation des éléments d'étiquetage : L'harmonisation des éléments d'étiquetage entre les différents composants des produits combinés est essentielle pour fournir des informations claires et cohérentes aux professionnels de la santé et aux patients. Veillez à ce que l'étiquetage représente correctement la fonctionnalité combinée et transmette les instructions, les avertissements et les modes d'emploi essentiels.
- Classification et atténuation des risques : Identifier et classer les risques associés à chaque composant du produit combiné. Évaluer les risques potentiels et déterminer les stratégies d'atténuation appropriées. Communiquer ces risques, ainsi que les précautions et les avertissements correspondants sur l'étiquette du produit, afin de garantir la sécurité du patient et le respect des exigences réglementaires en matière d'étiquetage.
- Considérations relatives à la langue et à l'interface utilisateur : Tenez compte des exigences linguistiques en matière d'étiquetage lorsque vous commercialisez des produits combinés à l'échelle internationale. Traduisez et localisez le contenu de l'étiquetage pour qu'il soit conforme aux réglementations en vigueur dans les différentes régions et qu'il tienne compte des préférences linguistiques du public cible. En outre, concevez des interfaces conviviales qui facilitent l'utilisation sûre et efficace des produits combinés.
- Ingénierie des facteurs humains (HFE) : La facilité d'utilisation des produits combinés est essentielle pour garantir la sécurité des patients. Appliquez les principes de l'ingénierie des facteurs humains pour vous assurer que l'étiquetage et les instructions d'utilisation sont intuitifs, facilement compréhensibles et compatibles avec l'interface utilisateur du composant du dispositif. Effectuez des tests de convivialité et répétez la conception afin de réduire le risque d'erreurs et d'optimiser l'expérience de l'utilisateur.
- Post-market Surveillance (PMS) mises à jour de l'étiquetage : surveiller en permanence la sécurité et les performances des produits combinés grâce à la PMS. Recenser et analyser rapidement les événements indésirables et les nouveaux problèmes de sécurité. Mettre à jour l'étiquetage, si nécessaire, afin de refléter toute nouvelle information, mise en garde relative à la sécurité ou modification des indications.
- Collaboration et communication réglementaire : L'étiquetage des produits combinés nécessite une collaboration étroite entre les équipes chargées de la réglementation, de la qualité et du marketing. Établir des canaux de communication efficaces avec les autorités réglementaires pour obtenir des conseils, clarifier les exigences et garantir la conformité tout au long du processus d'étiquetage. Tirer parti de l'expertise d'équipes interfonctionnelles pour élaborer un étiquetage complet et conforme.
Conclusion
L'étiquetage des produits combinés implique de naviguer dans des cadres réglementaires complexes, d'aborder la classification des risques et de garantir une communication efficace des informations relatives à la sécurité. En comprenant les défis uniques, en harmonisant les éléments d'étiquetage et en tirant parti de l'expertise réglementaire, les fabricants peuvent relever les défis avec facilité et donner la priorité à la conformité et à la sécurité des patients.
Soyez attentif aux exigences réglementaires et étiquetez correctement vos produits combinés afin que les professionnels de santé et les patients puissent les utiliser de manière sûre et efficace. En vous associant à un expert tel que Freyr réduire vos efforts au minimum. Contactez us pour en savoir plus !









