
Dans le domaine en constante évolution du développement pharmaceutique, le chemin qui mène de la découverte en laboratoire au traitement des patients est semé d'embûches réglementaires complexes. Ce processus comprend la demande d'autorisation de mise sur le marché (NDA), une étape cruciale qui englobe les efforts scientifiques et les investissements. Ce blog explore les subtilités des opérations NDA et offre des informations précieuses et des enseignements tirés par des vétérans du secteur.
NDA de la NDA
Les demandes d'autorisation de mise sur le marché d'un nouveau médicament sont l'aboutissement d'un travail approfondi de recherche, de développement et d'essais cliniques. Elles constituent un dossier complet destiné à convaincre les autorités réglementaires, telles que la Food and Drug Administration (FDA) aux États-Unis, qu'un nouveau médicament est sûr, efficace et prêt à être commercialisé.
La complexité du NDA
L'un des principaux obstacles à NDA réside dans le volume et la complexité des données requises. Les sociétés pharmaceutiques doivent se frayer un chemin à travers un labyrinthe de directives réglementaires tout en présentant des preuves claires et convaincantes des mérites de leurs produits pharmaceutiques. Cet exercice d'équilibre entraîne souvent des retards, des révisions coûteuses et, dans certains cas, des rejets purs et simples.
Pour mieux comprendre ce processus crucial, analysons les étapes clés de NDA et explorons les stratégies à adopter pour réussir à chaque étape.
Tableau 1 : Étapes clés de NDA
| Stade | Description | Meilleures pratiques |
|---|---|---|
| Recherche préclinique | Études en laboratoire et sur les animaux pour recueillir des données initiales | Assurer une conception solide de l'étude et une collecte méticuleuse des données |
| Essais cliniques | Essais sur l'homme menés en phases (I, II, III) | Mettre en œuvre des protocoles rigoureux et maintenir l'intégrité des données |
| Documentation | Compilation des données relatives à la sécurité, à l'efficacité et à la qualité | Organiser les données de manière systématique et veiller à la clarté de la présentation |
| Examen réglementaire | Soumission à FDA processus d'examen | Maintenir une communication ouverte avec les organismes de réglementation |
Rôle du partenariat réglementaire
Pour s'y retrouver dans NDA complexe NDA , de nombreuses sociétés pharmaceutiques se tournent vers des partenaires réglementaires pour obtenir de l'aide. Ces cabinets spécialisés offrent une expérience et une expertise considérables qui peuvent considérablement rationaliser le NDA .
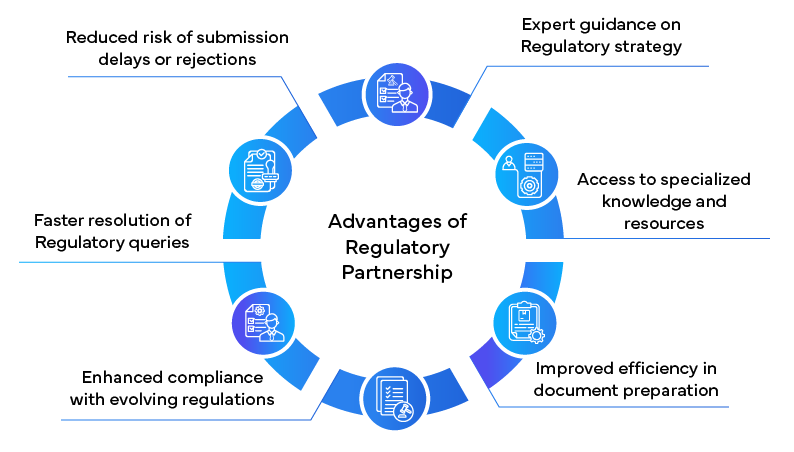
Enseignements tirés
À mesure que nous nous tournons vers l'avenir, l'importance d'opérations NDA efficaces NDA ne fera que croître. Avec l'accélération du rythme de l'innovation et l'évolution du paysage réglementaire, ceux qui maîtrisent ce processus critique seront les mieux placés pour offrir des traitements qui changent la vie des patients du monde entier.
Le chemin vers une NDA réussie NDA est rarement simple. Cependant, en adoptant une approche stratégique des opérations réglementaires, en tirant parti de partenariats avec des experts et en maintenant un engagement envers la qualité et la conformité, les sociétés pharmaceutiques peuvent considérablement améliorer leurs chances de NDA .









