
Le développement et l'autorisation des médicaments destinés aux enfants constituent un aspect essentiel des soins pédiatriques. Cependant, pour des raisons éthiques et pratiques, les essais cliniques impliquant des enfants sont souvent limités. Par conséquent, l'étiquetage des médicaments pédiatriques joue un rôle crucial pour garantir une utilisation sûre et appropriée des médicaments chez cette population vulnérable. Dans cet article, nous comparerons les exigences en matière d'étiquetage des médicaments pédiatriques dans l'Union européenne (UE) et aux États-Unis (US) afin de mieux comprendre les similitudes et les différences entre ces deux cadres réglementaires (02).
Exigences de l'UE en matière d'étiquetage pédiatrique
L'UE impose des exigences spécifiques en matière d'étiquetage pédiatrique des Produits médicaux. Ces exigences garantissent que les médicaments destinés aux enfants sont testés, autorisés et étiquetés de manière appropriée afin d'offrir des options thérapeutiques sûres et efficaces aux patients pédiatriques.
Assurer la sécurité des médicaments pédiatriques. Us
Garantir dès maintenant la sécurité des médicaments pédiatriques
Voici quelques aspects des exigences de l'UE en matière d'étiquetage pédiatrique :
- Plans d'investigation pédiatrique (PIP): un PIP doit être soumis à l'Agence européenne des médicaments (EMA) avant qu'un médicament puisse être approuvé pour les enfants. Il décrit les études et les données nécessaires pour évaluer la sécurité, l'efficacité et la posologie du médicament chez les populations pédiatriques.
- Autorisation de mise sur le marché en vue d'un usage pédiatrique (PUMA) : si un médicament a été étudié chez l'enfant et qu'il remplit les conditions requises, il peut recevoir une autorisation de mise sur le marché en vue d'un usage pédiatrique. Cette autorisation permet de commercialiser le médicament pour un usage pédiatrique.
- Formulations adaptées à l'âge: Les médicaments à usage pédiatrique doivent être disponibles dans des formulations adaptées aux différents groupes d'âge, telles que des liquides, des comprimés à croquer ou des dispositifs de dosage adaptés à l'âge.
- Résumé des caractéristiques du produit (SmPC) spécifique à la pédiatrie: le SmPC un document qui fournit des informations détaillées sur un médicament. Pour les produits pédiatriques, il doit inclure des détails spécifiques sur la posologie, l'administration et les considérations de sécurité pour différents groupes d'âge.
- Avertissements et précautions pédiatriques: L'étiquetage doit inclure toutes les mises en garde ou précautions spécifiques liées à l'utilisation du médicament chez les enfants, telles que les effets secondaires potentiels ou les interactions avec d'autres médicaments couramment utilisés chez les patients pédiatriques.
- Surveillance continue et mises à jour: Une fois qu'un médicament est approuvé pour un usage pédiatrique, des études post-autorisation peuvent être nécessaires pour recueillir des données supplémentaires sur sa sécurité et son efficacité. Ces études peuvent conduire à des mises à jour de l'étiquetage si nécessaire.
Exigences US en matière d'étiquetage US
Aux US, la Food and Drug Administration (FDA) a mis en œuvre la Pediatric Research Equity Act (PREA) et la Best Pharmaceuticals for Children Act (BPCA) afin de promouvoir la recherche et l'étiquetage des médicaments pédiatriques. La PREA exige des sociétés pharmaceutiques qu'elles mènent des études pédiatriques pour certains médicaments susceptibles d'être utilisés chez les enfants. La BPCA accorde une exclusivité commerciale supplémentaire de six (06) mois aux sociétés qui mènent ces études.
La FDA d'autres directives visant à garantir la sécurité, l'efficacité et le dosage approprié des médicaments pédiatriques, comme suit :
- Plans d'études pédiatriques (PSP): Les fabricants doivent soumettre des plans décrivant les études pédiatriques pour l'évaluation de la sécurité et de l'efficacité des médicaments.
- Informations spécifiques à l'âge: Les étiquettes doivent mentionner la posologie, les indications et les considérations de sécurité spécifiques à l'âge.
- Dosage en fonction du poids: Les recommandations de dosage en fonction du poids garantissent une administration précise.
- Effets indésirables: Fournir les effets indésirables et les données de sécurité spécifiques aux enfants.
- Formules pédiatriques spécifiques: Les médicaments peuvent nécessiter des formes de dosage spécifiques aux enfants (par exemple, des liquides et des comprimés à croquer).
- Ingénierie des facteurs humains: Les étiquettes doivent tenir compte de la facilité d'administration pour les soignants.
- Les notices d'information pour les patients: Des instructions claires concernant l'administration, la posologie et les effets secondaires sont nécessaires.
Le tableau ci-dessous présente les différences et les similitudes entre les exigences en matière d'étiquetage US dans l'Union européenne :
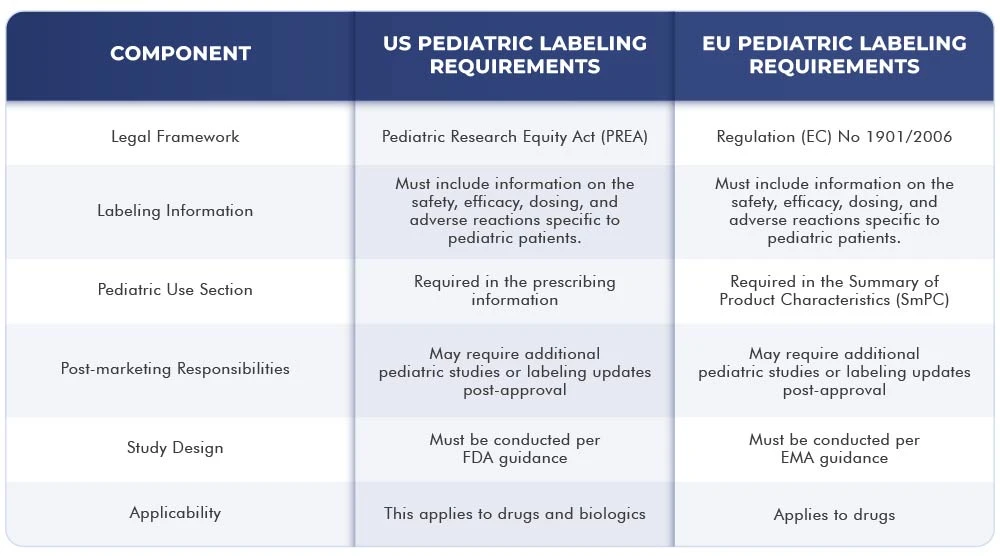
Conclusion
Les exigences en matière d'étiquetage des médicaments pédiatriques dans l'Union européenne et US à garantir une utilisation sûre et appropriée des médicaments chez les enfants. Bien qu'il existe des similitudes entre les deux cadres réglementaires, telles que la nécessité de mener des études pédiatriques et d'inclure des informations spécifiques à la pédiatrie dans l'étiquetage des médicaments, il existe également des différences notables. Il est essentiel que les entreprises pharmaceutiques, les prestataires de soins de santé et les organismes de réglementation comprennent ces similitudes et ces différences afin de garantir aux enfants l'accès à des médicaments sûrs et efficaces.
Consultez un expert reconnu en matière d'étiquetage, tel que Freyr vous conformer aux exigences spécifiques à chaque pays en matière d'étiquetage.









