
Les étiquettes des médicaments servent de guide de première main aux utilisateurs et les aident à utiliser les produits de manière qualitative. Il est donc très important que les informations disponibles sur les étiquettes soient cohérentes, faciles à lire, exemptes d'erreurs et conformes aux normes mondiales. Pour s'aligner sur ces normes, l'administration des produits thérapeutiques (TGA) a introduit quelques changements dans la manière dont les informations d'étiquetage sont présentées sur les produits. L'objectif de ces changements est d'améliorer la clarté et la cohérence des informations fournies aux professionnels de la santé.
Quels sont les changements apportés à l'étiquetage ?
Bien que les nouvelles informations soient déjà prises en compte et mises en œuvre par les fabricants, il est judicieux de les connaître en détail pour une présentation complète. En voici quelques-unes, sur lesquelles les fabricants doivent se pencher lorsqu'ils définissent leurs étiquettes de médicaments.
1. Informations sur l'ingrédient actif
Selon la nouvelle règle, les ingrédients actifs doivent être :
- Placé plus visiblement sur la face avant de la boîte de médicaments
- Doit être placé en dessous ou à côté du nom du médicament sur la face avant de l'emballage.
- Doit être facilement comparable entre les médicaments
2. Informations sur les médicaments
Pour que les utilisateurs et les professionnels de la santé puissent prendre une décision éclairée, les informations sur les médicaments doivent être plus claires :
- Des informations sanitaires essentielles sur des étiquettes distinctives
- Toutes les informations obligatoires doivent être présentées de manière plus claire et plus reconnaissable par rapport à la couleur de fond afin d'améliorer leur lisibilité.
- Les substances déclarables, telles que les allergènes, doivent être mentionnées sur l'étiquette.
3. Informations essentielles sur la santé
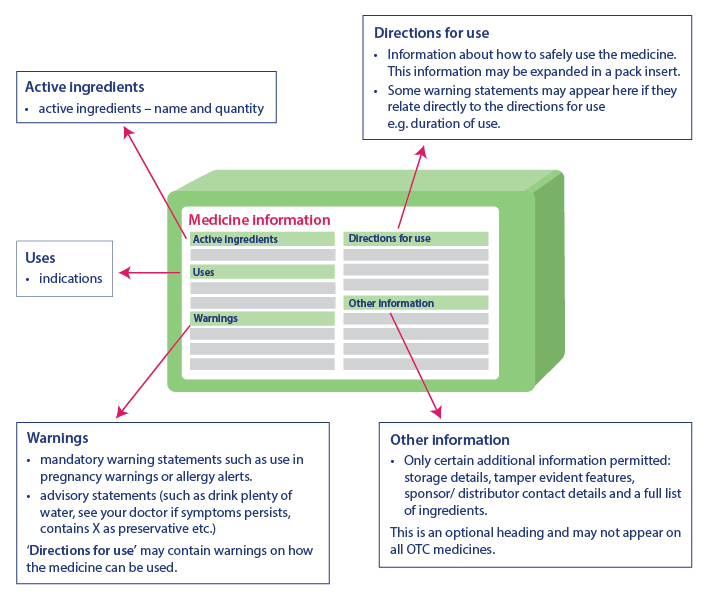
Les informations critiques pour la santé aident les consommateurs à utiliser le médicament en toute sécurité en fournissant des informations importantes. Les informations contenues dans le tableau des informations critiques sur la santé sont toujours présentées dans le même ordre, bien qu'il puisse y avoir une légère différence dans la représentation des informations. Les informations critiques sur la santé comportent les rubriques suivantes et les informations sont présentées dans le même ordre :
- Ingrédients actifs : Nom de l'ingrédient actif et sa quantité
- Indications : Utilisation du médicament
- Avertissements : Inclut les mises en garde, les conseils et les avertissements supplémentaires concernant l'utilisation du médicament dans la rubrique "Mode d'emploi".
- Mode d'emploi : contient des informations sur l'utilisation sûre du médicament.
- Autres informations : Comprend des informations telles que les détails de stockage, les caractéristiques d'inviolabilité, les coordonnées du promoteur, la liste des ingrédients, etc. Cette partie peut ne pas figurer sur tous les médicaments
Source : TGA
4. Dispensation en pharmacie
Selon la nouvelle règle, les changements suivants sont apportés aux distributeurs de médicaments :
- Afin d'améliorer l'identification des médicaments, les boîtes de médicaments délivrés sur ordonnance doivent porter le nom du médicament sur les trois faces non opposées.
- Les étiquettes des médicaments délivrés sur ordonnance doivent comporter un espace réservé de 70 x 30 millimètres, sauf s'ils sont fournis dans un emballage primaire ou un emballage de départ.
5. Informations sur les allergènes
Les médicaments doivent comporter les informations suivantes sur l'étiquette :
- Si elles sont présentes dans le médicament, toutes les substances doivent être déclarées sur l'étiquette.
- D'autres substances, telles que les crustacés, le poisson, les œufs, le soja, le lait et les fruits à coque, doivent être déclarées sur l'étiquette.
- Dans le cas de nouveaux allergènes, les fabricants peuvent ne pas les inclure avant la fin de la période de transition de 4 ans.
Bien que la TGA ait publié ces informations à l'intention des professionnels de la santé, nous considérons qu'il s'agit là d'une exigence essentielle pour les fabricants, qui doivent eux aussi étiqueter leurs produits de manière exhaustive. Ainsi, les professionnels de la santé peuvent consulter les informations mises à jour sans aucune confusion et guider les patients pour une consommation sûre. Il est bien connu que la TGA a accordé aux fabricants une période de transition de quatre ans pour mettre en œuvre ces changements. Après la date définie, les étiquettes des médicaments doivent être conformes aux nouvelles exigences en matière d'étiquetage. Restez informés. Restez en conformité.









