Services d'audit et de validation de la conformité des produits pharmaceutiques
Nos services permettent d'exploiter une décennie de compétences grâce à des évaluations de la conformité, des audits méticuleux et des processus de validation solides.
Parcourir les sujets
- Qu'est-ce que la conformité, l'audit et la validation dans le secteur pharmaceutique ?
- Quelle est l'importance de la conformité, de l'audit et de la validation dans l'industrie pharmaceutique ?
- Principaux défis dans le domaine de la conformité, de l'audit et de la validation
- Qu'est-ce qu'un audit GxP ?
- Comprendre les audits à distance
- Qu'est-ce que la validation des systèmes informatiques (CSV) et pourquoi est-elle cruciale dans l'industrie pharmaceutique ?
- Quelle est la différence entre CSV et Computer System Assurance (CSA) ?
- Quelles sont les composantes d'un programme CSA ?
- Comment la CSA contribue-t-elle à l'intégrité des données dans l'industrie pharmaceutique ?
- Quel est le rôle de la conformité réglementaire dans la CSA ?
- Comment un partenaire stratégique en matière de conformité réglementaire peut-il vous aider ?
- Pourquoi choisir Freyr?
- Nos services
Qu'est-ce que la conformité, l'audit et la validation dans le secteur pharmaceutique ?
Dernière mise à jour le : septembre 2024
Dans le domaine pharmaceutique, les processus de conformité, d'audit et de validation sont essentiels pour garantir le respect des normes réglementaires, l'intégrité des données et la production de produits sûrs et efficaces. La conformité consiste à aligner les opérations sur les réglementations industrielles et les politiques internes. Les audits, examens systématiques, permettent de vérifier la conformité, d'identifier les domaines d'amélioration et de réduire les risques. La validation garantit que les systèmes, les processus et les équipements répondent systématiquement à des exigences prédéfinies.
Les entreprises recherchent des conseils d'experts pour naviguer en toute transparence. Les leaders de l'industrie gèrent habilement ces processus, garantissant des normes mondiales sans compromettre l'efficacité ou la sécurité des produits. À mesure que le secteur pharmaceutique évolue, les approches stratégiques en matière de conformité, d'audit et de validation deviennent déterminantes pour un succès durable. En respectant ces processus, les entreprises satisfont aux critères réglementaires et favorisent une culture de l'excellence et de l'innovation dans un secteur dynamique et exigeant.
Collaborez avec un partenaire de confiance pour obtenir des conseils stratégiques et des solutions sur mesure qui permettent à vos opérations pharmaceutiques de prospérer dans un paysage réglementaire dynamique.

Quelle est l'importance de la conformité, de l'audit et de la validation dans l'industrie pharmaceutique ?
La conformité, l'audit et la validation sont des éléments essentiels de l'industrie pharmaceutique, qui garantissent que les produits sont sûrs, efficaces et fabriqués conformément aux normes réglementaires.
- Garantir la sécurité et l'efficacité des produits : Le respect des réglementations garantit que les produits pharmaceutiques répondent à des normes strictes de sécurité et d'efficacité avant d'être mis sur le marché. Cela implique des tests rigoureux et des processus de validation pour confirmer que les produits fonctionnent comme prévu et ne présentent pas de risques pour les patients.
- Maintien du respect des réglementations : Des audits et une validation réguliers aident les entreprises à se conformer aux réglementations complexes et évolutives établies par les autorités sanitaires. Il s'agit notamment de respecter les bonnes pratiques de fabrication (BPF), les bonnes pratiques cliniques (BPC) et d'autres normes industrielles, ce qui réduit le risque de sanctions réglementaires et de rappels de produits.
- Amélioration de l'assurance qualité : Les processus de validation, y compris la validation des équipements et des systèmes, garantissent que les processus de fabrication et d'essai produisent systématiquement des produits de haute qualité. Les audits vérifient que ces processus sont suivis correctement, ce qui permet d'améliorer la qualité et la fiabilité des produits.
- Favorise l'accès au marché et la réputation : Des pratiques efficaces de conformité et de validation favorisent l'accès au marché en démontrant le respect des exigences réglementaires. La réputation et la crédibilité de l'entreprise s'en trouvent renforcées, ce qui lui permet de gagner la confiance des professionnels de la santé, des patients et des organismes de réglementation.
- Faciliter l'amélioration continue : Les audits permettent de mieux comprendre l'efficacité des processus et les domaines à améliorer, ce qui conduit à un meilleur contrôle de la qualité et à de meilleures pratiques opérationnelles. Cette évaluation et cet ajustement continus permettent de maintenir des normes élevées et de s'adapter aux changements de réglementation et aux meilleures pratiques du secteur.
Principaux défis dans le domaine de la conformité, de l'audit et de la validation
Le secteur de la conformité, de l'audit et de la validation est confronté à plusieurs défis majeurs qui peuvent avoir un impact sur la capacité des entreprises pharmaceutiques à répondre aux exigences réglementaires et à maintenir des normes élevées de qualité et de sécurité :
| Défi | Description |
|---|---|
| Conformité réglementaire | Les entreprises pharmaceutiques doivent se conformer à des réglementations strictes émanant d'agences telles que la FDA et l'EMA, qui exigent une documentation rigoureuse et des mesures de contrôle de la qualité. Le non-respect de ces règles peut entraîner des sanctions sévères, notamment des amendes et des rappels de produits. |
| Contrôle d'accès et sécurité | Il est essentiel de veiller à ce que seul le personnel autorisé puisse accéder aux zones et aux informations sensibles. Cela implique la mise en place de systèmes de contrôle d'accès avancés et le maintien de la cybersécurité contre les menaces, ce qui peut s'avérer complexe et coûteux. |
| Validation du système informatique (CSV) | La validation des systèmes informatiques utilisés dans les environnements GxP est essentielle, mais souvent lourde et mal définie. Le processus nécessite beaucoup de temps et de ressources, en particulier lorsqu'une approche standard est appliquée sans discernement. |
| Formation et sensibilisation des employés | Des programmes de formation continue sont nécessaires pour s'assurer que les employés comprennent les protocoles de conformité et leur importance. Une formation inadéquate peut conduire à la non-conformité et à des erreurs dans les processus. |
| Documentation et archivage | Le maintien d'une documentation précise et complète est vital pour la conformité. Une documentation inadéquate est un problème courant qui peut conduire à des observations réglementaires et à des échecs lors des audits. |
| Intégrité des données | Il est essentiel de garantir l'intégrité et l'exactitude des données, surtout lorsqu'il s'agit de gérer d'importants volumes d'informations. Les défis à relever sont notamment la manipulation manuelle des données et la nécessité de disposer de systèmes de gestion des données robustes. |
| Gestion des fournisseurs | La dépendance à l'égard de fournisseurs tiers pour les logiciels et les services nécessite une validation approfondie et des contrôles de conformité. Gérer ces relations et s'assurer qu'elles respectent les normes réglementaires peut s'avérer difficile. |
| Complexité technologique | La complexité croissante des technologies, y compris l'IA et les systèmes cloud-based , présente de nouveaux défis en matière de validation et nécessite une adaptation permanente à l'évolution des paysages réglementaires. |
| Contrôle de qualité inadéquat | De nombreuses entreprises pharmaceutiques éprouvent des difficultés à maintenir des normes de haute qualité dans l'ensemble des processus, ce qui peut entraîner une contamination, une contamination croisée et d'autres problèmes de qualité. |
| Amélioration et suivi continus | Les audits et inspections réguliers sont essentiels pour identifier les faiblesses des systèmes de conformité. Cependant, de nombreuses organisations ne parviennent pas à mettre en œuvre des mesures proactives d'amélioration continue |
- Évolution des réglementations : Il peut être difficile de suivre l'évolution rapide des réglementations et des lignes directrices dans les différentes régions. Les entreprises pharmaceutiques doivent continuellement mettre à jour leurs pratiques de conformité afin d'adhérer aux normes réglementaires nouvelles ou révisées, ce qui peut nécessiter des ressources et des ajustements importants.
- Complexité des normes mondiales : Naviguer entre les exigences réglementaires diverses et complexes des différents pays et régions ajoute au défi. Chaque juridiction peut avoir son propre ensemble de règles et de normes, ce qui rend difficile l'obtention d'une conformité cohérente sur les marchés mondiaux.
- Intégrité et sécurité des données : Il est essentiel de garantir l'intégrité et la sécurité des données tout au long des processus de conformité, d'audit et de validation. Les entreprises doivent mettre en place des systèmes et des contrôles solides pour se protéger contre les violations, les altérations ou les inexactitudes des données, qui peuvent avoir de graves conséquences sur l'approbation des produits et la sécurité des patients.
- Contraintes en matière de ressources : Des ressources limitées, notamment en termes de temps, de personnel et de budget, peuvent nuire à l'efficacité des activités de conformité et d'audit. Les entreprises ont souvent du mal à trouver un équilibre entre le maintien de la conformité et la nécessité d'allouer des ressources à d'autres fonctions essentielles de l'entreprise.
- Gestion de la documentation et de l'archivage : Une documentation et un archivage adéquats sont essentiels pour démontrer la conformité et mener des audits efficaces. Cependant, la gestion de grandes quantités de documents, la garantie de leur exactitude et le maintien de leur accessibilité peuvent s'avérer difficiles, en particulier dans un environnement très réglementé.
- Intégration des nouvelles technologies : L'intégration de technologies innovantes dans les processus de conformité et de validation existants peut s'avérer complexe. Si des technologies telles que l'automatisation et l'AI (Artificial Intelligence) offrent des avantages significatifs, leur intégration doit être gérée avec soin pour s'assurer qu'elles sont conformes aux exigences réglementaires et qu'elles n'introduisent pas de nouveaux risques.
- Formation et compétences : Il est essentiel de veiller à ce que le personnel soit correctement formé et compétent en matière de conformité, d'audit et de processus de validation. Des programmes de formation continue sont nécessaires pour tenir le personnel au courant des changements réglementaires et des meilleures pratiques, ce qui peut nécessiter beaucoup de ressources.
- Traiter les résultats de l'audit : Il peut être difficile de traiter et de corriger efficacement les problèmes identifiés lors des audits. Les entreprises doivent mettre en œuvre rapidement des actions correctives et préventives tout en veillant à ce que ces actions ne perturbent pas les opérations en cours et n'affectent pas la qualité des produits.
- Équilibrer la conformité et l'innovation : Il peut être difficile de trouver un équilibre entre le respect de réglementations strictes et la poursuite de l'innovation. Les entreprises doivent naviguer dans le paysage réglementaire tout en continuant à développer et à introduire de nouveaux produits et de nouvelles technologies.
- Assurer la cohérence des opérations : Maintenir la cohérence des pratiques de conformité et des processus de validation entre les différents services, installations et étapes du cycle de vie du produit est essentiel mais difficile. La variabilité des pratiques peut entraîner des problèmes de non-conformité et de qualité.
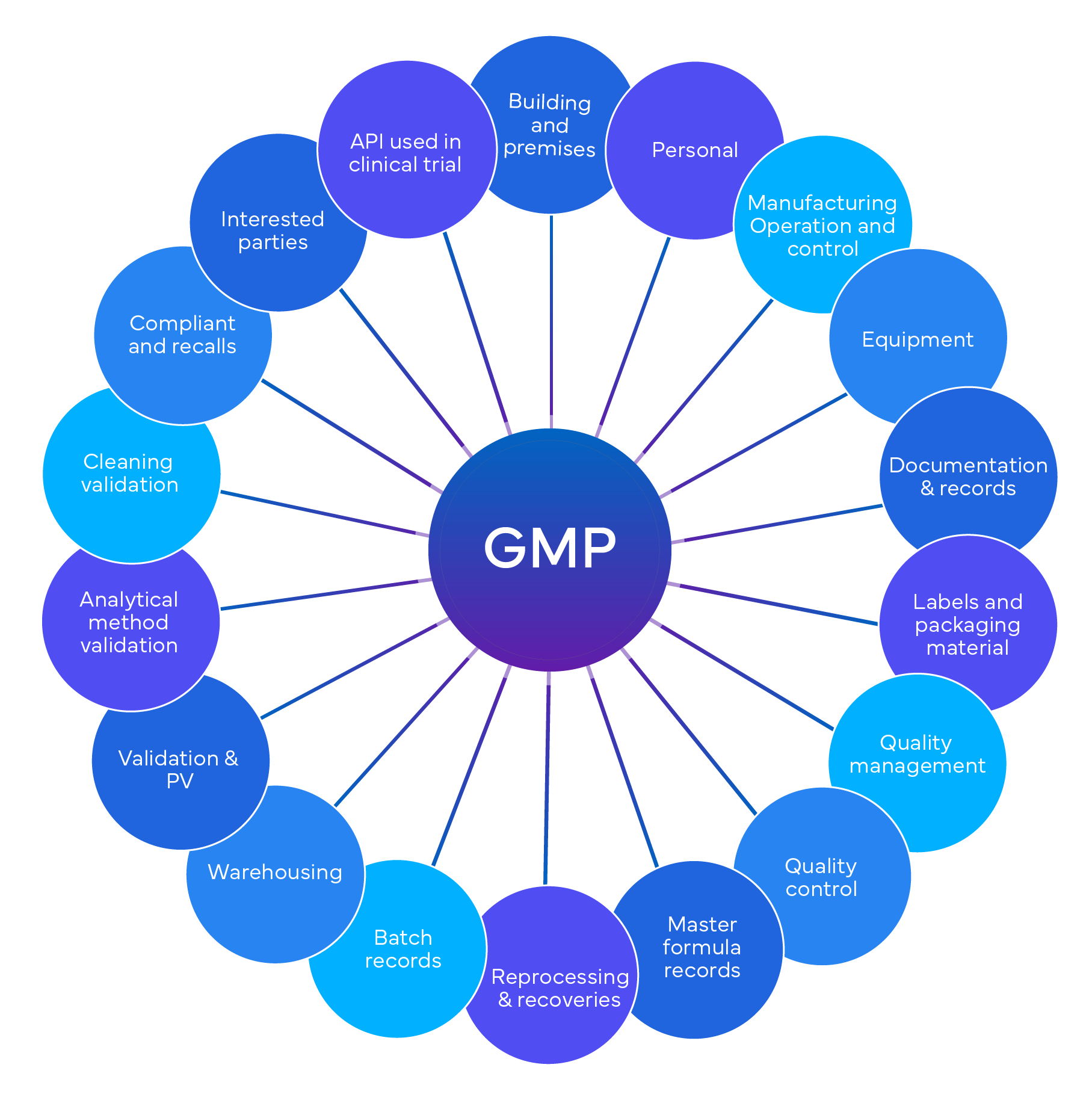
Qu'est-ce qu'un audit GxP ?
Qu'est-ce qu'un audit indépendant de conformité aux bonnes pratiques de fabrication et who le réalise ?
Un audit de conformité GxP est un processus mis en place pour s'assurer que les entreprises respectent les normes prédéfinies de qualité, de sécurité et de conformité réglementaire. Il peut couvrir divers aspects des produits et processus pharmaceutiques, tels que les bonnes pratiques de laboratoireGLP, les bonnes pratiques cliniques (BPC), les bonnes pratiques de fabrication (BPF) et les bonnes pratiques de pharmacovigilance (BPV).
L'audit évalue le niveau de conformité avec les lois, les règlements, les lignes directrices et les Standard Operating Procedures (SOPs) applicables et identifie les lacunes, les risques et les possibilités d'amélioration. L'audit fournit également des recommandations et des actions correctives pour répondre aux constatations et améliorer les systèmes de qualité.
Les avantages d'un audit GxP sont les suivants :
- Fournir une évaluation impartiale et objective des systèmes de qualité et du niveau de conformité.
- Renforcer la confiance des régulateurs, des clients, des fournisseurs et des autres parties prenantes.
- Réduire la probabilité et la gravité des inspections, des observations et des sanctions réglementaires.
- Améliorer la qualité, la sécurité et l'efficacité des produits et des processus.
- Accroître l'efficience et l'efficacité des opérations et réduire les coûts et les erreurs.
- Soutenir l'amélioration et l'innovation continues des produits et des processus.
Un audit GxP est réalisé par un auditeur qualifié et expérimenté ou par une équipe d'auditeurs possédant les connaissances, les compétences et les qualifications requises dans le secteur pharmaceutique et dans le domaine GxP spécifique. L'auditeur ou l'équipe d'audit doit être indépendant(e) de l'entreprise auditée et respecter les normes professionnelles et les principes éthiques de l'audit. Il/elle doit également utiliser des outils et des méthodes appropriés pour mener l'audit, tels que des listes de contrôle, des entretiens, des observations, des examens de documents, des échantillonnages, des tests, etc. Freyr offre end-to-end dans le cadre des audits GxP. En tant que leader du secteur, nos experts vous aideront à atteindre la conformité en toute simplicité.
Cadre réglementaire pour les audits GxP
La conformité aux bonnes pratiques de fabrication est un ensemble de règles qui régissent diverses industries réglementées, notamment les produits pharmaceutiques, les dispositifs médicaux, les denrées alimentaires, les boissons et la biotechnologie. L'objectif principal de la conformité GxP est de maintenir la qualité des produits et de garantir la sécurité publique. Voici quelques points clés :
- Aperçu de la conformité aux bonnes pratiques de fabrication:
- Les bonnes pratiques de fabrication englobent plusieurs normes, notamment les bonnes pratiques de laboratoireGLP, les bonnes pratiques cliniques (BPC), les bonnes pratiques de fabrication (BPF) et les bonnes pratiques de pharmacovigilance (BPV).
- Ces normes garantissent que les produits sont testés, fabriqués et manipulés de manière approfondie tout au long de leur cycle de vie.
- Conférence internationale sur l'harmonisationICH:
- L'ICH fournit des lignes directrices pour la conformité GxP.
- La directiveICH Q7A sur les bonnes pratiques de fabrication traite spécifiquement des pratiques de fabrication des ingrédients pharmaceutiques actifsAPIs.
- Inspections de FDA:
- La Food and Drug Administration (FDA) des États-Unis effectue des inspections pour évaluer la conformité aux réglementations GxP.
- Ces inspections permettent d'évaluer le respect des réglementations et des lignes directrices spécifiques de FDA .
- Inspections de Health Canada:
- Health Canada, l'autorité réglementaire au Canada, effectue également des inspections pour s'assurer de la conformité aux bonnes pratiques de fabrication.
- Ces inspections portent sur différents aspects, notamment la fabrication, le contrôle de la qualité et la distribution.
- Critères d'évaluation pour les audits GxP:
La conformité aux GxP lors des audits indépendants est généralement évaluée en fonction d'une série de critères, dont les suivants :
- Exigences réglementaires: Conformité aux réglementations, lignes directrices et lois spécifiques applicables au domaine des BPx (par exemple, réglementations de FDA , lignes directrices de ICH ou normes ISO).
- Systèmes de qualité: Évaluation des systèmes de gestion de la qualité, des pratiques de documentation et de l'archivage.
- Validation des processus: Vérification que les processus sont validés et répondent à des critères prédéfinis.
- Formation et compétences: Évaluation de la formation et des qualifications du personnel.
- Gestion des risques: Identification et atténuation des risques liés à la qualité et à la sécurité des produits.
Découvrez comment un expert en réglementation peut vous aider à créer le cadre d'audit GxP idéal adapté à vos besoins et vous aider à rester en conformité avec les réglementations mondiales.
Avantages des audits de conformité aux bonnes pratiques de fabrication
Les audits GxP présentent de nombreux avantages pour toute organisation. Tout d'abord, ils fournissent une évaluation impartiale et indépendante des risques et de la conformité au sein de l'organisation, ce qui permet aux entreprises d'identifier les domaines de non-conformité ou les risques potentiels qui pourraient être négligés lors des audits internes. Ces audits sont essentiels pour garantir que les entreprises respectent certaines normes de qualité, de sécurité et de conformité réglementaire.
| Aspect | Description |
|---|---|
| Examen approfondi | Évaluation approfondie par une tierce partie qualifiée afin d'identifier les domaines de non-conformité. |
| Normes réglementaires | Respect des normes GxP (bonnes pratiques) telles que GMP, GCP et GLP. |
| Un champ d'application sur mesure | Champ d'application de l'audit personnalisé en fonction des produits et processus spécifiques. |
| Auditeurs qualifiés | Auditeurs expérimentés connaissant la réglementation. |
| Cadre réglementaire | Respect des directives ICH Q7A, de la FDA et de Health Canada . |
| Avantages | Évaluations impartiales, prévention des risques, maintien de la qualité et évolutivité. |
Voici quelques points clés concernant les audits de conformité aux bonnes pratiques de fabrication :
- Examen approfondi: Les audits GxP impliquent un processus d'examen approfondi mené par une organisation ou un consultant tiers qualifié. L'objectif est d'identifier les domaines de non-conformité au sein de l'organisation et de formuler des recommandations en vue d'une amélioration.
- Normes réglementaires: Les réglementations examinées au cours de ces audits sont définies par les normes GxP (bonnes pratiques), telles que les bonnes pratiques de fabrication (GMP), les bonnes pratiques cliniques (GCP) et les bonnes pratiques de laboratoireGLP. Ces normes garantissent que les produits, les services et les processus répondent systématiquement aux exigences réglementaires pertinentes.
- Un champ d'application sur mesure : Le champ d'application d'un audit indépendant est adapté aux produits et processus spécifiques de l'organisation. Il peut porter sur la gestion du personnel, la gestion des installations, la tenue des registres, l'assurance et le contrôle de la qualité, la conception des produits et des processus et les opérations techniques.
- Auditeurs qualifiés: L'audit doit être réalisé par un auditeur qualifié et expérimenté who connaît les réglementations applicables et possède l'expertise nécessaire pour évaluer efficacement les procédures et les processus de l'organisation.
- Cadre réglementaire: Les audits GxP suivent des cadres tels que le guide des bonnes pratiques de fabrication Q7A de la Conférence internationale sur l'harmonisationICH), les inspections de FDA et les inspections de Health Canada . Ces cadres fournissent des orientations sur les exigences de base en matière de production, d'assurance qualité, de distribution et d'autres activités essentielles liées à la fabrication de produits sûrs.
- Avantages: Les audits GxP offrent des évaluations impartiales, aident à prévenir les problèmes de non-conformité, à maintenir les normes de qualité et à garantir la responsabilité. L'externalisation de ces audits permet d'accéder à l'expertise, à l'objectivité, à la rentabilité et à l'évolutivité, tout en permettant aux entreprises de se concentrer sur leurs compétences de base.
Si vous êtes à la recherche de solutions de conformité GxP, pensez à Freyr. Nous sommes spécialisés dans la conformité réglementaire, l'assurance qualité et la sécurité dans l'industrie des sciences de la vie. Grâce à notre expertise, vous pouvez garantir le respect des normes GxP, rationaliser les processus et maintenir des produits et services de haute qualité.
Conseils pour préparer votre organisation à un audit
La préparation de votre organisation à un audit est un processus stratégique qui implique une planification méticuleuse et une approche proactive. Tout d'abord, veillez à ce que tous les dossiers, la documentation et les fichiers pertinents soient organisés et facilement accessibles. Un système de classement bien organisé facilite le processus d'audit et donne une image positive du professionnalisme de votre organisation.
Deuxièmement, procédez à un pré-audit interne afin d'identifier les domaines de préoccupation potentiels. Cette auto-évaluation vous permet de résoudre les problèmes ou les divergences avant l'audit externe. En résolvant les problèmes de manière proactive, vous démontrez votre engagement en matière de conformité et de transparence.
Troisièmement, communiquer et collaborer efficacement avec l'équipe d'audit. Fournir les informations nécessaires, l'accès au personnel concerné et un environnement de travail propice. Une communication claire permet d'établir un rapport positif avec les auditeurs, ce qui favorise une atmosphère de collaboration au cours du processus d'audit.
Enfin, veillez à ce que votre équipe soit bien formée et consciente du processus d'audit. Sensibilisez les employés à leur rôle, à leurs responsabilités et à l'importance de la conformité. En inculquant une culture de préparation et de coopération, votre organisation pourra affronter les audits avec confiance et professionnalisme.
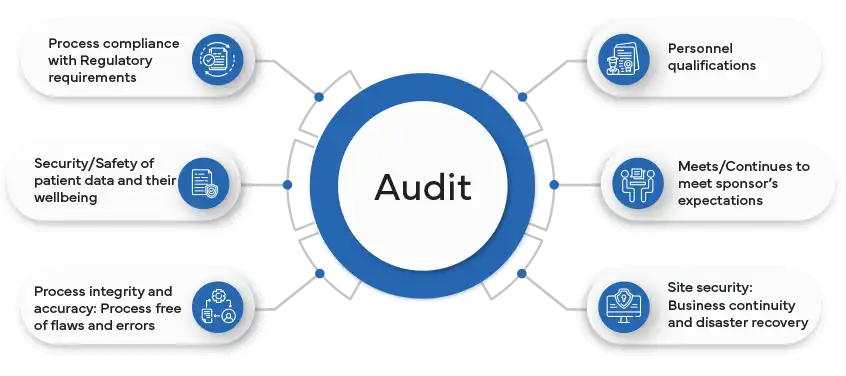
Comprendre les audits à distance
Qu'est-ce qu'un audit à distance dans l'industrie pharmaceutique et en quoi diffère-t-il des audits traditionnels sur site ?
Un audit à distance dans l'industrie pharmaceutique est une évaluation complète des processus, des installations et des systèmes d'une entreprise menée par les autorités réglementaires ou les auditeurs sans présence physique sur place. Cet audit est facilité par des outils de communication numérique, des logiciels de collaboration et l'accès à distance aux documents et systèmes pertinents. Il vise à garantir la conformité aux normes réglementaires, à évaluer les systèmes de gestion de la qualité et à vérifier le respect des bonnes pratiques de fabrication (BPF), des bonnes pratiques cliniques (BPC) ou d'autres réglementations applicables.
La différence entre les audits à distance et les audits traditionnels sur site réside dans l'absence de présence physique lors d'un audit à distance. Au lieu de se rendre dans les locaux de l'entreprise, les auditeurs s'appuient sur des interactions virtuelles, une documentation électronique et un accès à distance aux systèmes. Cette approche offre flexibilité et efficacité, permettant aux audits de se dérouler indépendamment des distances géographiques et des restrictions de voyage. Toutefois, pour garantir l'efficacité des audits à distance, il convient de relever des défis tels que l'observation directe limitée des installations et les problèmes potentiels de cybersécurité.
Malgré les différences, les objectifs des audits traditionnels et à distance restent les mêmes : vérifier la conformité, identifier les domaines à améliorer et garantir la qualité et la sécurité des produits pharmaceutiques. Le choix entre un audit à distance et un audit sur site dépend de facteurs tels que la nature de l'audit, les exigences réglementaires et les capacités de l'entreprise à faciliter une évaluation approfondie par des moyens à distance.
Freyr s'appuie sur une décennie d'expertise pour fournir des solutions réglementaires inégalées, garantissant la conformité et le succès dans le paysage pharmaceutique dynamique.
Explorez l'excellence réglementaire avec us - votre partenaire stratégique pour une conformité réussie dans l'industrie pharmaceutique en constante évolution. Connectez-vous avec us pour naviguer en toute transparence dans les complexités de la réglementation.
Quels sont les problèmes susceptibles de se poser lors des audits à distance et comment les résoudre pour garantir des évaluations approfondies ?
Lors des audits à distance, plusieurs problèmes peuvent se poser, mais les organisations peuvent prendre des mesures pour les résoudre et garantir des évaluations approfondies. Voici quelques défis majeurs et leurs solutions potentielles :
- Établir des relations clés avec les parties prenantes de l'audit:
- Défi: Le travail à distance peut entraver le développement de relations solides avec les parties prenantes de l'audit.
- Solution: Des réunions virtuelles régulières, une communication ouverte et un engagement actif peuvent aider à construire et à maintenir des relations. Utilisez les appels vidéo pour établir un lien personnel.
- Investir dans la technologie pour le travail virtuel:
- Défi: Les audits à distance s'appuient fortement sur la technologie, et des outils inadéquats peuvent nuire à l'efficacité.
- La solution: Investir dans des logiciels de gestion d'audit robustes, des plateformes de communication sécurisées et des outils de collaboration. Veillez à ce que les auditeurs disposent du matériel et des logiciels nécessaires.
- Développer les employés et promouvoir une culture positive à distance:
- Défi: Le travail à distance peut conduire à l'isolement et entraver le développement professionnel.
- Solution: Offrir une formation virtuelle, un mentorat et des possibilités de développement des compétences. Favoriser une culture positive en organisant des activités de renforcement de l'esprit d'équipe, en reconnaissant les mérites de chacun et en procédant à des contrôles réguliers.
- Cultiver un état d'esprit intentionnel et adaptatif:
- Défi: Les auditeurs à distance doivent s'adapter à des circonstances changeantes et rester concentrés.
- La solution: Encourager la flexibilité, l'adaptabilité et l'esprit de croissance. Former les auditeurs à gérer les situations inattendues et à adapter leur approche en fonction des besoins.
Freyr est un partenaire de confiance en matière de conformité réglementaire et de solutions de sécurité pour l'industrie des sciences de la vie. Grâce à une expertise approfondie, une technologie innovante et une présence mondiale, Freyr permet aux organisations de naviguer en toute transparence dans des paysages réglementaires complexes. Découvrez nos services et us dès aujourd'hui pour améliorer votre parcours de conformité.
En quoi Freyr est-il mieux placé pour vous aider dans vos audits à distance ?
Freyr, avec son expertise décennale, excelle dans la facilitation d'audits à distance transparents pour l'industrie pharmaceutique. En s'appuyant sur des technologies de pointe et une connaissance approfondie des exigences réglementaires, Freyr garantit un processus d'audit complet et efficace, en relevant des défis tels qu'une présence physique limitée et des préoccupations en matière de cybersécurité.
Notre équipe d'experts en réglementation est experte dans l'utilisation de solutions numériques innovantes, garantissant une évaluation virtuelle complète de vos processus, de vos installations et de votre documentation. Nos résultats probants en matière d'audits à distance reflètent notre engagement à fournir des solutions réglementaires fiables et efficaces, adaptées aux besoins évolutifs du secteur pharmaceutique. Avec Freyr, vous bénéficiez d'un partenaire de confiance who comprend les complexités des audits à distance et qui apporte une approche proactive et collaborative pour améliorer votre parcours de conformité.
Qu'est-ce que la validation des systèmes informatiques (CSV) et pourquoi est-elle cruciale dans l'industrie pharmaceutique ?
La validation des systèmes informatiques (CSV) est un processus essentiel de l'industrie pharmaceutique qui garantit l'intégrité, la fiabilité et la conformité des systèmes informatiques utilisés à diverses fins. Entrons dans les détails :
- Définition et objectif:
- La CSV est le processus documenté qui garantit qu'un système informatique produira des informations ou des données répondant à des exigences prédéfinies.
- Son objectif principal est de valider et de vérifier que les systèmes informatiques fonctionnent toujours comme prévu, en maintenant l'exactitude, la fiabilité et la sécurité des données.
- Importance dans l'industrie pharmaceutique:
- Conformité réglementaire: L'industrie pharmaceutique est soumise à des réglementations strictes (telles que les bonnes pratiques de fabrication ou BPF) afin de garantir la qualité, la sécurité et l'efficacité des produits.
- Intégrité des données: Des données précises et fiables sont essentielles pour le développement de médicaments, les essais cliniques, la fabrication et la distribution.
- Atténuation des risques: CSV aide à identifier et à atténuer les risques associés aux systèmes informatiques, en évitant les erreurs, les pertes de données et la non-conformité.
- Sécurité des patients: Les systèmes correctement validés contribuent à la sécurité des patients en garantissant une qualité constante et le respect des normes.
- Aspects clés du CSV:
- Définition des exigences: Définir clairement les exigences du système, les fonctionnalités et les attentes des utilisateurs.
- Conception et configuration: Développer et configurer le système conformément aux spécifications.
- Essais et qualification: Des essais rigoureux (y compris des essais unitaires, des essais d'intégration et des essais d'acceptation par l'utilisateur) pour vérifier les performances du système.
- Documentation: Maintenir une documentation complète tout au long du cycle de vie du système.
- Contrôle des changements: Gérer les modifications apportées au système, en veillant à ce qu'elles ne compromettent pas son intégrité.
- Défis relevés par le CSV:
- Intégrité des données: Empêcher l'accès non autorisé, la corruption ou la manipulation des données.
- Sécurité du système: Protection contre les cybermenaces et les modifications non autorisées.
- Piste d'audit: Maintenir une trace électronique indélébile des données pour les audits réglementaires.
- Maintenance de la validation: Réviser et mettre à jour régulièrement la validation pour l'adapter aux changements du système.
Quelle est la différence entre CSV et Computer System Assurance (CSA) ?
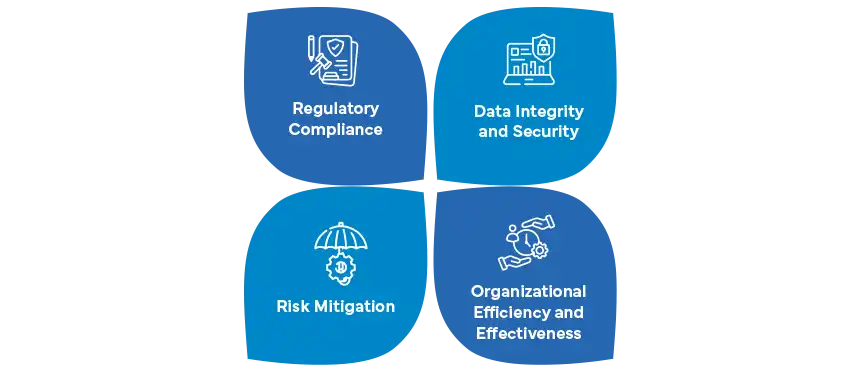
La validation des systèmes informatiques (CSV) et l'assurance des systèmes informatiques (CSA) représentent des approches distinctes pour garantir l'intégrité et la conformité des systèmes informatiques dans l'industrie pharmaceutique. La CSV, une pratique de longue date, se concentre principalement sur la phase de validation du cycle de vie d'un système, en s'assurant que les systèmes logiciels répondent aux exigences réglementaires par le biais de protocoles prédéfinis. En revanche, la CSA adopte une approche plus large et plus dynamique, couvrant l'ensemble du cycle de vie d'un système informatisé, du développement et de la mise en œuvre à l'utilisation opérationnelle et à la mise hors service éventuelle.
La CSV répond à la nécessité de processus de validation rigoureux, en mettant l'accent sur des approches basées sur le risque pour identifier et atténuer les problèmes potentiels. Toutefois, le paysage pharmaceutique évolue, ce qui a conduit à l'émergence de la CSA en tant que stratégie plus globale. La CSA va au-delà de la validation en adaptant des méthodologies agiles et en intégrant une surveillance continue tout au long du cycle de vie d'un système. Cette perspective holistique permet aux organisations de gérer de manière proactive les risques, notamment en matière de cybersécurité et d'intégrité des données, en accord avec l'importance croissante accordée par l'industrie à la technologie et à la sécurité des données.
L'adaptabilité de la CSA est précieuse dans un environnement réglementaire qui évolue rapidement. Alors que CSV adhère aux pratiques de validation traditionnelles, CSA s'aligne sur les attentes en constante évolution des autorités réglementaires. Elle va au-delà des efforts de revalidation périodiques, en intégrant une surveillance continue, des analyses de données en temps réel et des stratégies proactives de gestion des risques pour garantir une conformité continue et des performances optimales. À l'heure où l'industrie pharmaceutique adopte la transformation numérique, il devient impératif de comprendre les nuances entre CSV et CSA pour les entreprises qui souhaitent conserver une longueur d'avance en matière de conformité réglementaire et d'intégrité des systèmes.
Dans ce contexte, Freyr, fort de son expérience et de son expertise, est bien équipé pour guider les entreprises pharmaceutiques dans les méandres du CSV et du CSA, en proposant des solutions sur mesure pour répondre à l'évolution des exigences en matière de conformité réglementaire et de progrès technologiques.
Quelles sont les composantes d'un programme CSA ?
L'assurance des logiciels informatiques (CSA) est une approche moderne qui renforce la fiabilité, la sécurité et la conformité des systèmes informatiques. Examinons ses composantes et ses avantages à long terme :
- Approche fondée sur les risques:
- Composante: La CSA se concentre sur l'évaluation et la gestion des risques.
- Importance: L'identification des domaines critiques permet de répartir efficacement les efforts de validation.
- Tests non scriptés:
- Composant: L'ASC comprend des tests non scriptés au-delà des cas de test scriptés traditionnels.
- Importance: Les tests non scriptés imitent les scénarios du monde réel, ce qui permet de découvrir des problèmes cachés.
- Contrôle continu des performances:
- Composante: La CSA implique un contrôle permanent des performances du système.
- Importance: La détection précoce des anomalies permet d'éviter les pannes de système et les problèmes d'intégrité des données.
- Contrôle des données:
- Composante: La CSA met l'accent sur la qualité et l'intégrité des données.
- Importance: Garantit des données exactes pour la prise de décision et la conformité.
- Activités de validation externe:
- Composant: Le CSA collabore avec les fournisseurs de logiciels pour la validation externe.
- Importance: La validation indépendante renforce la confiance et réduit les biais.
- Passage de CSV à CSA:
- Premières étapes:
- Comprendre les principes de la CSA.
- Évaluer les risques des systèmes existants.
- Hiérarchiser les fonctionnalités critiques.
- Avantages:
- Réduction de la charge de travail liée à la validation.
- Réaction souple aux changements.
- Amélioration de la fiabilité du système.
- Premières étapes:
- Fiabilité du système à long terme:
- La CSA assure :
- Adaptabilité: Les systèmes évoluent sans compromettre la fiabilité.
- Sécurité: Protection contre les cybermenaces.
- Conformité: Alignement permanent sur les réglementations.
- Qualité: Qualité constante des données et des produits.
- La CSA assure :
Comment la CSA contribue-t-elle à l'intégrité des données dans l'industrie pharmaceutique ?
La CSA veille à l'intégrité des données dans l'industrie pharmaceutique en garantissant l'exactitude, la cohérence et la fiabilité des données tout au long du cycle de vie d'un système. Contrairement aux approches traditionnelles, la CSA adopte une stratégie holistique qui va au-delà de la validation, en s'attaquant activement aux défis potentiels et aux divergences qui peuvent survenir au fil du temps.
L'une des contributions de l'ASC à l'intégrité des données réside dans ses capacités de contrôle continu. Plutôt que de s'appuyer uniquement sur des efforts de validation périodiques, la CSA implique des analyses de données en temps réel et des mesures proactives de gestion des risques. Cette approche permet aux organisations de détecter et de traiter les divergences potentielles entre les données, empêchant ainsi les inexactitudes de s'accumuler au fil du temps. L'accent mis par la CSA sur un modèle de cycle de vie dynamique et adaptatif garantit que l'intégrité des données reste une préoccupation constante, conformément aux attentes des régulateurs.
Pour éviter les divergences de données au fil du temps, la CSA a adopté plusieurs mesures stratégiques. Tout d'abord, elle utilise de solides processus de contrôle des changements, documentant méticuleusement toute modification des systèmes ou des processus informatisés susceptible d'avoir une incidence sur l'intégrité des données. Des vérifications et des évaluations régulières des systèmes sont effectuées afin d'identifier et de rectifier les problèmes potentiels avant qu'ils ne s'aggravent. En outre, la CSA insiste sur l'importance des programmes de formation et de sensibilisation des utilisateurs afin de s'assurer que le personnel comprend l'importance du maintien de l'intégrité des données et adhère aux meilleures pratiques.
En conclusion, l'approche proactive et globale de la CSA en matière d'intégrité des données en fait une solution stratégique pour l'industrie pharmaceutique. En intégrant une surveillance continue, une gestion des risques et des mesures rigoureuses de contrôle des changements, la CSA maintient l'intégrité des données et veille à ce que les sociétés pharmaceutiques soient bien préparées à naviguer dans le paysage en constante évolution des attentes des organismes de réglementation. Alors que les entreprises s'efforcent de respecter les normes les plus strictes en matière d'intégrité des données, la CSA apparaît comme un allié clé dans leur parcours, s'alignant sur les tendances de l'industrie et les avancées en matière de réglementation.
Pour les organisations qui cherchent des conseils sur la mise en œuvre de stratégies CSA efficaces, Freyr est un partenaire fiable qui offre des solutions sur mesure pour relever les défis uniques du paysage pharmaceutique.
Quel est le rôle de la conformité réglementaire dans la CSA ?
La conformité réglementaire est la pierre angulaire de la CSA, car elle garantit que les entreprises pharmaceutiques respectent les normes et les directives en constante évolution tout au long du cycle de vie d'un système. Contrairement à la validation des systèmes informatiques (CSV), la CSA met l'accent sur la conformité continue et l'adaptabilité à l'évolution du paysage réglementaire. Au fur et à mesure que les entreprises passent de la CSV à la CSA, il devient primordial de se tenir au courant de l'évolution des réglementations.
Dans le contexte de la CSA, la conformité réglementaire consiste à aligner les systèmes informatisés sur les exigences réglementaires mondiales et locales, du développement à l'utilisation opérationnelle et à la mise hors service éventuelle. La CSA met l'accent sur la conformité continue plutôt que sur la validation périodique, en favorisant une approche proactive pour répondre rapidement aux changements réglementaires potentiels. Cet alignement stratégique garantit que les entreprises pharmaceutiques sont bien préparées à répondre aux attentes des autorités réglementaires, tout en préservant l'intégrité des données, la sécurité des patients et la fiabilité globale du système.

Des contacts réguliers avec les autorités réglementaires, la participation à des forums industriels et l'abonnement à des publications réglementaires fournissent des informations précieuses sur l'évolution des normes. Le recours à l'expertise de consultants en réglementation et l'investissement dans la formation continue du personnel impliqué dans les processus CSA renforcent encore la sensibilisation à la réglementation. La collaboration avec des partenaires réglementaires, tels que Freyr Solutions, offre une approche proactive, garantissant l'accès à des informations réglementaires actualisées et à des solutions sur mesure pour naviguer en toute transparence dans la transition.
La conformité réglementaire dans le cadre de la CSA est un engagement dynamique et continu qui s'aligne sur l'évolution de l'industrie vers l'adaptabilité et l'amélioration continue. Pour les entreprises qui passent de CSV à CSA, il est essentiel de rester informé, d'être proactif et de s'associer à des experts en réglementation, afin de faciliter une évolution harmonieuse et conforme dans le paysage pharmaceutique en perpétuelle mutation.
En tant que partenaire réglementaire de confiance, Freyr fournit le soutien et l'expertise nécessaires pour guider les entreprises dans cette transition, en garantissant l'excellence réglementaire et la conformité à l'era CSA.
Comment un partenaire stratégique en matière de conformité réglementaire peut-il vous aider ?
Un partenaire stratégique en matière de conformité réglementaire joue un rôle essentiel en veillant à ce que les entreprises pharmaceutiques respectent les exigences réglementaires et maintiennent des normes de qualité élevées. Voici comment il peut vous aider :
- Conseils d'experts : Un partenaire stratégique fournit des conseils d'expert sur la manière de naviguer dans des réglementations complexes et évolutives dans différentes régions. Il offre un aperçu des derniers changements réglementaires, aidant les entreprises à ajuster leurs pratiques et à rester en conformité.
- Des processus rationalisés : Ils aident à rationaliser les processus de conformité en mettant en œuvre les meilleures pratiques et des flux de travail efficaces. Il s'agit notamment de développer des systèmes robustes de documentation, d'audit et de validation, de réduire les charges administratives et d'améliorer l'efficacité globale.
- Atténuation des risques : En identifiant les risques potentiels de conformité et les vulnérabilités, un partenaire stratégique aide à atténuer les risques avant qu'ils ne deviennent des problèmes. Il procède à des audits et à des évaluations approfondies afin de s'assurer que tous les processus sont conformes et de combler les éventuelles lacunes de manière proactive.
- Formation et soutien : Ils offrent une formation et un soutien pour s'assurer que le personnel est bien informé des exigences réglementaires et des meilleures pratiques. Cela permet de renforcer les compétences internes et de s'assurer que toutes les personnes impliquées dans les activités de conformité sont au fait des normes en vigueur.
- Intégration technologique : Un partenaire stratégique aide à l'intégration de technologies innovantes, telles que l'automatisation et l'IA, dans les processus de conformité. Ils veillent à ce que ces technologies soient mises en œuvre efficacement et conformément aux exigences réglementaires, en améliorant l'intégrité des données et l'efficacité des processus.
- Documentation et archivage : Ils gèrent la création, l'organisation et la maintenance de la documentation cruciale en matière de conformité. Ils veillent à ce que tous les dossiers soient exacts, complets et facilement accessibles en cas d'audit ou d'inspection.
- Soumissions et approbations réglementaires : Ils s'occupent de la préparation et de la soumission des documents et des demandes réglementaires. Il s'agit notamment de s'assurer que les soumissions répondent à toutes les exigences nécessaires et de gérer les communications avec les autorités réglementaires afin de faciliter les approbations dans les délais impartis.
- Actions correctives et préventives : Un partenaire stratégique soutient l'élaboration et la mise en œuvre d'actions correctives et préventives en réponse à des conclusions d'audit ou à des problèmes de conformité. Il veille à ce que ces actions soient efficaces et ne perturbent pas les opérations en cours.
- Stratégie de conformité mondiale : Ils élaborent et mettent en œuvre des stratégies de mise en conformité à l'échelle mondiale, en tenant compte des diverses exigences réglementaires des différents marchés. Cela permet de s'assurer que les produits répondent à toutes les normes nécessaires à leur distribution et à leur utilisation au niveau international.
- Suivi continu : Ils assurent un suivi et une assistance continus afin de tenir les entreprises informées de toute mise à jour ou modification de la réglementation. Cette approche proactive aide les entreprises à rester conformes et à s'adapter aux nouvelles réglementations au fur et à mesure qu'elles apparaissent.
Pourquoi choisir Freyr?
Plus de dix ans d'excellence en matière de conformité réglementaire.
Gamme complète de conformité, d'audit et de validation.
Expertise dans divers secteurs d'activité et zones géographiques.
Utilise des outils innovants pour obtenir des résultats précis.
Des professionnels qualifiés ayant une connaissance approfondie du secteur.
Gestion réussie de défis complexes en matière de conformité.
Questions fréquemment posées
La conformité pharmaceutique implique le respect des lois, des règlements et des lignes directrices qui régissent l'industrie pharmaceutique. Elle garantit que les entreprises alignent leurs opérations sur les normes de l'industrie, préservant ainsi la sécurité et l'efficacité des produits tout en maintenant l'intégrité des données.
L'objectif d'un audit est d'évaluer systématiquement l'adhésion d'une entreprise aux normes réglementaires et aux politiques internes. Les audits permettent d'identifier les domaines à améliorer, d'atténuer les risques et de s'assurer que les processus sont efficaces pour produire des produits pharmaceutiques sûrs et conformes.
La validation dans le domaine pharmaceutique est le processus qui consiste à confirmer que les systèmes, les processus et les équipements répondent de manière cohérente aux exigences prédéfinies. Elle est essentielle pour garantir la conformité aux normes réglementaires et pour maintenir la qualité et la sécurité des produits pharmaceutiques tout au long de leur cycle de vie.
Ces processus sont essentiels pour garantir la sécurité et l'efficacité des produits, maintenir l'adhésion aux réglementations, améliorer l'assurance qualité, soutenir l'accès au marché et faciliter l'amélioration continue. Ils aident les entreprises à respecter des normes strictes et à instaurer un climat de confiance avec les parties prenantes.
Parmi les défis à relever, citons l'évolution des réglementations, la garantie de l'intégrité des données, la gestion des contraintes en matière de ressources et le maintien d'une documentation appropriée. En outre, l'intégration de technologies innovantes et la garantie de la compétence du personnel peuvent compliquer les efforts de mise en conformité.
Les audits GxP sont des évaluations menées pour garantir le respect des normes de bonnes pratiques (GxP), qui comprennent les bonnes pratiques de fabrication (GMP), les bonnes pratiques cliniques (GCP) et les bonnes pratiques de laboratoireGLP. Ces audits permettent d'identifier les lacunes en matière de conformité et d'améliorer les systèmes de qualité.
Un audit indépendant de conformité GxP est une évaluation objective du respect par une entreprise des normes de qualité et de réglementation. Mené par des auditeurs qualifiés, il permet d'identifier les risques et les domaines à améliorer, afin de renforcer la conformité et la sécurité des produits.
Les audits GxP fournissent des évaluations impartiales, renforcent la conformité réglementaire et identifient les domaines d'amélioration opérationnelle. Ils contribuent à maintenir des normes de haute qualité et à instaurer la confiance avec les régulateurs et les clients.
CSV garantit que les systèmes informatisés utilisés dans les produits pharmaceutiques produisent systématiquement des données fiables et répondent aux exigences réglementaires. Il est essentiel pour maintenir l'intégrité des données, atténuer les risques et garantir la sécurité des patients tout au long du cycle de vie du produit.
La CSV se concentre sur la validation de la conformité d'un système aux exigences réglementaires et de ses performances, tandis que la CSA englobe une approche plus large qui comprend l'assurance continue des performances et de la conformité du système tout au long de son cycle de vie.










