Questions fréquemment posées
Les affaires réglementairesRA dans l'industrie pharmaceutique consistent à garantir la qualité, la sécurité et l'efficacité des médicaments tout au long de leur cycle de vie. Les professionnels des RA s'adaptent aux exigences complexes des autorités sanitaires mondiales et veillent à la conformité des médicaments, de leur découverte à leur commercialisation. Ils servent de lien de communication entre les entreprises pharmaceutiques et les autorités réglementaires du monde entier.
L'objectif premier de la réglementation de l'industrie pharmaceutique est de préserver la santé publique en s'assurant que les nouveaux médicaments sont sûrs et efficaces avant leur mise sur le marché. Les organismes de réglementation appliquent des normes rigoureuses en matière de tests et d'évaluation, minimisant ainsi les risques potentiels pour la santé. Cette surveillance réglementaire donne confiance dans les traitements médicaux mis à la disposition du public.
Les professionnels des affaires réglementaires veillent à ce que les produits pharmaceutiques soient conformes aux normes réglementaires tout au long de leur cycle de vie. Ils participent à la conception des essais cliniques, à l'autorisation de mise sur le marché et à la gestion post-approbation, garantissant ainsi une conformité permanente et facilitant les modifications nécessaires des produits. Leur expertise aide les entreprises à commercialiser efficacement des produits sûrs et efficaces.
La gestion du cycle de vie des produits pharmaceutiques consiste à maintenir la viabilité d'un produit depuis son développement jusqu'à sa post-approbation. Elle comprend des stratégies de développement clinique, d'autorisation de mise sur le marché et de respect permanent des normes réglementaires. Une gestion efficace du cycle de vie garantit que le produit reste sûr et efficace tout au long de sa présence sur le marché.
La réglementation pharmaceutique a considérablement évolué, passant des listes de médicaments médiévales aux efforts modernes d'harmonisation internationale. Parmi les étapes clés, citons la loi US Food and Drugs Act de 1906 et la création de la Conférence internationale sur l'harmonisation (ICH) en 1990. Ces développements ont renforcé les normes mondiales en matière de sécurité et d'efficacité des médicaments.
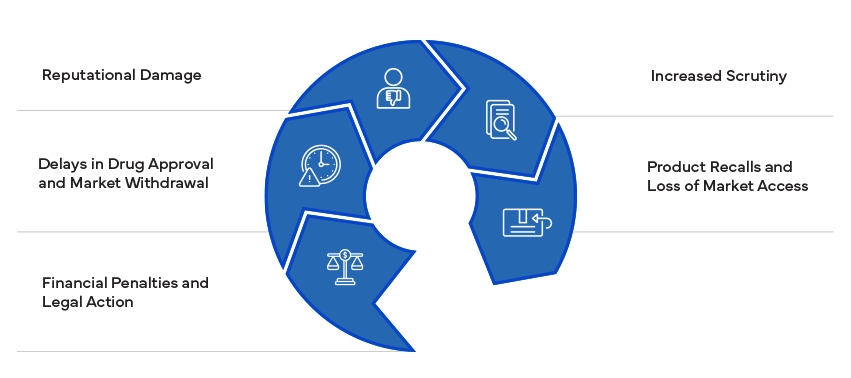
Le non-respect des normes réglementaires peut avoir des conséquences importantes, notamment des amendes, des litiges et des retraits de produits. Elle peut nuire à la réputation d'une entreprise et entraîner une surveillance accrue de la part des autorités réglementaires. Garantir la conformité est essentiel pour éviter ces risques et maintenir l'accès au marché.
Freyr offre des solutions réglementaires complètes, soutenant ses clients depuis les premiers stades du développement jusqu'à la commercialisation. Ses services comprennent la préparation de la documentation pour les autorités sanitaires, l'identification des défis réglementaires et des conseils sur les stratégies de post-commercialisation. L'expertise de Freyr permet d'accélérer le développement des produits et leur mise sur le marché.
L'harmonisation réglementaire mondiale vise à rationaliser les processus de développement et d'enregistrement des médicaments dans les différents pays. Elle minimise les essais sur les animaux et garantit la santé publique en alignant les exigences réglementaires au niveau international. Cette harmonisation facilite l'introduction efficace de nouveaux traitements sur les marchés mondiaux.
Les agences réglementaires telles que la FDA aux États-Unis et l'EMA dans l'Union européenne appliquent des normes visant à garantir la sécurité et l'efficacité des médicaments. Elles supervisent des processus complets de test et d'évaluation avant que les médicaments puissent être commercialisés. Ces agences établissent un équilibre entre la nécessité de nouveaux traitements et la minimisation des risques potentiels pour la santé.
Le cadre d'Global Regulatory intelligence de Freyr fournit des informations actualisées sur les réglementations mondiales et les positions des autorités sanitaires. Ce cadre est intégré dans les projets des clients afin d'améliorer la réussite spécifique au marché. Il soutient la planification stratégique et la conformité réglementaire dans de multiples zones géographiques.