Artwork conformes aux réglementations pharmaceutiques
Garantir la conformité et l'efficacité artwork des emballages pharmaceutiques, artwork la conception à la commercialisation.
Parcourir les sujets
- Que sont Artwork réglementaire ?
- Quels sont les éléments clés des artwork réglementaire ?
- Quelle est l'importance de la conformité réglementaire dans l'industrie pharmaceutique ?
- Aperçu des exigences réglementaires relatives Artwork le secteur pharmaceutique
- Quel est l'impact des progrès technologiques sur Artwork réglementaires ?
- Autorités réglementaires et lignes directrices au niveau mondial
- Quelles sont les principales réglementations et normes applicables aux Artwork pharmaceutiques ?
- Quel est l'impact de la non-conformité dans Artwork réglementaires ?
- Quels sont les défis Artwork sont confrontées les entreprises pharmaceutiques en matière d'Artwork ?
- Comment votre équipe gère-t-elle Artwork ?
- Quels sont les signes indiquant que votre entreprise a besoin d'un prestataire Artwork ?
- Quels sont les avantages d'un partenariat avec un prestataire Artwork ?
- Comment Freyr peut-il vous aider à l'échelle mondiale ?
- Pourquoi Freyr?
- Nos services
Que sont Artwork réglementaire ?
Dernière mise à jour le : septembre 2024
Dans le domaine hautement réglementé des produits pharmaceutiques, artwork réglementaire jouent un rôle essentiel dans la création, la gestion et la soumission de artwork aux normes réglementaires strictes. Ces services englobent une gamme spécialisée de solutions visant à garantir la conformité aux réglementations et normes mondiales régissant les étiquettes, les emballages et autres supports imprimés associés aux produits pharmaceutiques. En apportant leur expertise en matière de artwork , Conformité du labelling localisation, de traduction, d'intelligence réglementaire, Conformité du labelling gestionartwork et d'assurance qualité, artwork réglementaires sont indispensables aux entreprises pharmaceutiques qui cherchent à naviguer efficacement dans le paysage réglementaire complexe. Leur attention méticuleuse aux détails garantit la sécurité des patients, favorise la conformité et facilite l'entrée sans heurts des produits pharmaceutiques sur le marché.
De plus, dans un environnement où les exigences réglementaires évoluent constamment, artwork réglementaire offrent un soutien et des conseils continus aux entreprises pharmaceutiques. En se tenant au courant des mises à jour réglementaires et en appliquant les meilleures pratiques, ces services garantissent que les emballages et l'étiquetage des produits pharmaceutiques restent conformes aux dernières réglementations, atténuant ainsi les risques et préservant l'intégrité des produits tout au long de leur cycle de vie.

Quels sont les éléments clés des artwork réglementaire ?
Les principaux éléments des artwork réglementaires contribuent collectivement à garantir la conformité aux exigences réglementaires, à améliorer la qualité et l'efficacité des emballages et des étiquettes pharmaceutiques, et à protéger la santé et la sécurité des patients.
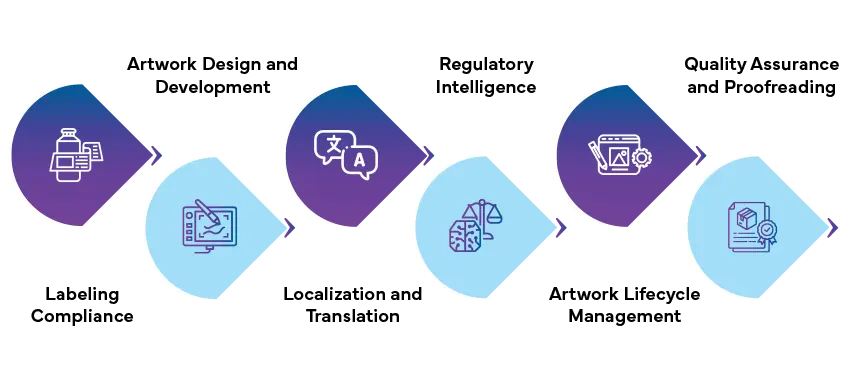
Conformité du labelling
- Veiller à ce que les étiquettes des produits contiennent des informations exactes et conformes aux exigences réglementaires.
- Examiner et vérifier le contenu de l'étiquetage pour s'assurer qu'il est exact et complet et qu'il respecte les directives réglementaires.
- Orienter la conception, le format, la taille des caractères et les symboles des étiquettes afin d'en assurer la conformité et la lisibilité.
Artwork et développement Artwork
- Collaborer avec des graphistes et des experts en réglementation afin de créer artwork répondent aux exigences réglementaires tout en préservant l'identité de la marque.
- Développer des emballages qui communiquent efficacement les informations essentielles aux utilisateurs finaux, y compris les instructions de dosage, les avertissements et les précautions.
- Incorporer les symboles, icônes et avertissements réglementaires conformément aux lignes directrices réglementaires.
Localisation et traduction
- Adapter artwork les étiquettes aux différents marchés et langues afin de se conformer aux exigences réglementaires régionales.
- Traduire avec précision le contenu de l'étiquetage en veillant à ce qu'il soit linguistiquement et culturellement approprié.
- Effectuer des contrôles de validation linguistique et d'assurance qualité pour vérifier l'exactitude et la cohérence du contenu traduit.
Veille réglementaire
- Suivi des changements et mises à jour réglementaires susceptibles d'avoir une incidence sur artwork .
- Fournir en temps utile des informations et des conseils sur l'évolution des normes et des lignes directrices en matière de réglementation.
- Aider les entreprises pharmaceutiques à s'y retrouver dans les paysages réglementaires complexes et à adapter artwork changements réglementaires.
Gestion Artwork
- Gérer l'ensemble artwork , depuis le développement du concept jusqu'à l'approbation finale et la production.
- Mettre en œuvre des processus de contrôle des changements afin de suivre et de gérer artwork et les mises à jour artwork .
- Garantir la cohérence, la précision et la conformité entre artwork et itérations artwork .
Assurance qualité et relecture
- Effectuer des examens d'assurance qualité et des contrôles de relecture afin d'identifier les erreurs, les incohérences et les écarts par rapport aux exigences réglementaires.
- Mettre en œuvre des processus de contrôle qualité rigoureux afin de garantir que artwork aux normes les plus élevées en matière de qualité et de précision.
- Fournir des recommandations et des mesures correctives pour résoudre les problèmes identifiés et améliorer artwork .
Quelle est l'importance de la conformité réglementaire dans l'industrie pharmaceutique ?
La conformité réglementaire dans le secteur pharmaceutique concerne l'adhésion aux règlements et statuts prescrits établis par les organismes de réglementation régissant l'industrie. Cet impératif implique une compréhension approfondie des lois et règlements pertinents applicables aux activités de l'entreprise, suivie d'une adhésion méticuleuse à ces mandats afin d'atténuer les pénalités potentielles ou les répercussions juridiques. Dans le domaine pharmaceutique, la conformité réglementaire englobe diverses facettes allant de la garantie de la sécurité des produits au maintien de pratiques commerciales éthiques.
L'importance de la conformité réglementaire ne peut être surestimée, car elle sert de garde-fou, protégeant les consommateurs des risques potentiels associés aux produits ou aux services, tout en garantissant la légalité des activités des entreprises. La non-conformité entraîne des conséquences importantes, notamment des amendes élevées et, dans les cas les plus graves, des poursuites pénales. Par conséquent, les entreprises pharmaceutiques doivent respecter avec diligence les normes de conformité afin d'éviter à l'avance de telles conséquences négatives.
Le maintien d'une conformité continue nécessite une approche proactive, impliquant une vigilance permanente à l'égard des évolutions du secteur et des mises à jour réglementaires. Cela implique une surveillance fréquente des plateformes gouvernementales faisant autorité pour les révisions législatives et l'abonnement à des publications pertinentes pour avoir un aperçu des changements réglementaires. En outre, une compréhension approfondie des obligations organisationnelles en vertu des lois en vigueur est impérative pour formuler et exécuter une stratégie de conformité complète, garantissant ainsi une adhésion durable aux mandats réglementaires.
Aperçu des exigences réglementaires relatives Artwork le secteur pharmaceutique
Dans le secteur pharmaceutique, le respect des dispositions réglementaires relatives artwork primordial pour garantir une utilisation efficace et sûre des Produits médicaux satisfaisant aux exigences légales. Ces exigences comprennent un large éventail de directives et de normes régissant la conception, le contenu et la présentation des emballages et des étiquettes des produits pharmaceutiques.
Avant tout, artwork pharmaceutiques artwork être conformes aux réglementations prescrites par les agences sanitaires faisant autorité, telles que la Food and Drug Administration (FDA aux États-Unis, l'Agence européenne des médicaments (EMA) en Europe et les entités analogues à l'échelle mondiale. Ces mandats imposent l'inclusion d'informations essentielles sur l'emballage et l'étiquetage, notamment l'identification du produit, les instructions posologiques, les mises en garde, les contre-indications et les dates de péremption.
En outre, il est impératif de respecter des protocoles spécifiques de formatage et de conception pour garantir la cohérence, la lisibilité et l'uniformité des différents formats et dimensions d'emballage. Cela nécessite le respect de critères concernant les dimensions des polices, la différenciation des couleurs et l'emplacement stratégique des détails essentiels afin d'optimiser la clarté et de réduire la probabilité d'erreurs de médication.
De plus, des mesures rigoureuses d'assurance qualité sont nécessaires pour valider la précision, l'exhaustivité et la conformité réglementaire artwork pharmaceutiques artwork leur mise en œuvre. Cela implique généralement des évaluations approfondies menées par des spécialistes des affaires réglementaires, des professionnels de l'assurance qualité et, parfois, des conseillers réglementaires externes afin d'identifier et de corriger tout écart ou non-conformité.
En résumé, la conformité aux directives réglementaires relatives artwork pharmaceutiques artwork indispensable pour préserver le bien-être des patients, garantir l'efficacité des produits et atténuer les risques juridiques et réglementaires liés à la non-conformité. Les entreprises pharmaceutiques doivent rester vigilantes dans le suivi de l'évolution des cadres réglementaires et affiner en permanence leurs artwork afin de garantir la conformité et de maintenir des normes de qualité et de sécurité inégalées dans leurs offres.
Quel est l'impact des progrès technologiques sur Artwork réglementaires ?
artwork réglementaires a connu une transformation profonde grâce aux progrès constants de la technologie. Ces avancées ont non seulement rationalisé les opérations, mais aussi amélioré la précision, l'efficacité et le respect des normes réglementaires dans le domaine pharmaceutique.
Voici une analyse approfondie de l'influence de la technologie sur artwork réglementaires :
Amélioration de l'efficacité opérationnelle et optimisation des processus
- Utilisation de logiciels Artwork et de gestion Artwork : des outils logiciels spécialisés ont remplacé les méthodes manuelles, facilitant ainsi le développement, la modification et le contrôle des versions des artwork.
- Passage aux soumissions électroniques : L'adoption généralisée par les agences réglementaires de systèmes de soumission électronique a permis d'éliminer la dépendance à l'égard de la documentation papier, ce qui a accéléré les processus d'approbation.
- Intégration des plateformes de collaboration : Les plateformes en ligne permettent une collaboration transparente entre les parties prenantes, en favorisant une meilleure communication et en rationalisant les procédures d'examen et d'approbation.
Amélioration de la précision et de l'intégrité des données
- Mécanismes automatisés de saisie des données : l'intégration avec des systèmes d'entreprise tels que la gestion des informations produit (PIM) réduit les erreurs de saisie manuelle et garantit l'uniformité artwork .
- Déploiement des signatures numériques et des pistes d'audit : les fonctionnalités de signature électronique et les pistes d'audit complètes renforcent l'intégrité et la traçabilité des données tout au long du artwork .
- Utilisation d'outils de validation : des outils de validation automatisés identifient les éventuelles divergences dans artwork , réduisant ainsi le risque de non-conformité.
Meilleure accessibilité aux marchés mondiaux et initiatives d'harmonisation
- Adoption de systèmes de gestion de la traduction : les solutions logicielles accélèrent la traduction et la localisation des artwork divers marchés mondiaux, garantissant la conformité réglementaire et répondant aux besoins démographiques variés des patients.
- Accessibilité aux bases de données d'informations réglementaires : Les référentiels en ligne permettent d'accéder aux dispositions réglementaires et aux documents d'orientation de plusieurs juridictions, ce qui facilite la mise en conformité à l'échelle mondiale.
- Promotion des initiatives d'harmonisation : la collaboration entre les organismes de réglementation favorise l'harmonisation des exigences en matière d'étiquetage, ce qui simplifie artwork pour les marchés internationaux.
Exploration des technologies émergentes
- Intégration de l'intelligence artificielle (IA) : les solutions basées sur l'IA analysent artwork les non-conformités, automatisent les tâches répétitives et personnalisent les informations relatives aux patients afin de renforcer leur engagement.
- Mise en œuvre de la réalité augmentée (RA) : La technologie AR superpose des informations interactives sur les emballages, fournissant aux patients des détails supplémentaires sur le produit et des instructions d'utilisation.
- Utilisation de la blockchain : la technologie blockchain renforce la sécurité et la traçabilité des données tout au long du artwork , favorisant ainsi la confiance et la transparence dans le cadre réglementaire.
Ces avancées technologiques ont profondément influencé artwork réglementaire, ouvrant la voie à un environnement plus efficace, plus précis et accessible à l'échelle mondiale. En adoptant ces innovations et en relevant de manière proactive les défis qui y sont associés, les entreprises peuvent garantir leur conformité, leur efficacité et leur réactivité face aux demandes en constante évolution des patients et des autorités réglementaires dans le secteur pharmaceutique dynamique.
Autorités réglementaires et lignes directrices au niveau mondial
Naviguer dans le paysage complexe des réglementations mondiales régissant artwork pharmaceutiques artwork un défi de taille. Cette section se penche sur les principales autorités réglementaires et leurs directives correspondantes afin de vous fournir des informations essentielles :
Naviguer dans le paysage complexe des réglementations mondiales régissant artwork pharmaceutiques artwork un défi de taille. Cette section se penche sur les principales autorités réglementaires et leurs directives correspondantes afin de vous fournir des informations essentielles :
Administration américaine des denrées alimentaires et des médicamentsFDA
Autorité : La FDA supervise l'étiquetage et l'emballage des médicaments humains et vétérinaires aux États-Unis.
Lignes directrices clés :
- Code des réglementations fédérales (CFR) Titre 21, parties 201 et 601 : Ces sections définissent les exigences en matière d'étiquetage pour les médicaments et les produits biologiques.
- Ligne directrice à l'intention de l'industrie : Labeling for Human Prescription Drugs and Over-the-counter Drugs (Étiquetage des médicaments humains délivrés sur ordonnance et des médicaments en vente libre) : Ce document fournit des recommandations détaillées concernant le contenu, le format et la présentation des étiquettes.
- Lignes directrices du Conseil international pour l'harmonisation des exigences techniques relatives aux produits pharmaceutiques à usage humainICH) : La FDA adopte fréquemment les directives pertinentes de ICH concernant les normes d'étiquetage et y fait référence.
Agence européenne des médicamentsEMA
Autorité : EMA compétente pour l'autorisation et la surveillance des Produits médicaux usage humain et vétérinaire dans l'Union européenne (UE).
Lignes directrices clés :
- Règlement (CE) n° 726/2004 de la Commission : ce règlement définit les exigences en matière d'étiquetage Produits médicaux usage humain au sein de l'UE.
- Directive relative à Labelling Produits médicaux usage humain : cette directive fournit des conseils exhaustifs sur le contenu, le format et la présentation des étiquettes.
- Lignes directrices de ICH : Comme la FDA, l'EMA incorpore et fait référence aux lignes directrices ICH concernant les protocoles d'étiquetage.
Organisation mondiale de la santéWHO
Autorité : L'WHO joue un rôle de chef de file et d'orientation au niveau mondial en ce qui concerne les réglementations pharmaceutiques, en vue d'une harmonisation et d'une normalisation à l'échelle mondiale.
Lignes directrices clés :
- Annexe 9 des lignes directrices de WHO sur les bonnes pratiques de fabrication (BPF) : cette annexe propose des recommandations pour l'étiquetage et l'emballage des produits pharmaceutiques.
- Listes modèles de médicaments essentiels de WHO : Ces listes préconisent des médicaments de base dans divers environnements de soins de santé, souvent accompagnés de stipulations d'étiquetage spécifiques.
Conseil international d'harmonisationICH
Rôle : L ICH est une initiative mondiale regroupant les autorités réglementaires d'Europe, du Japon, des États-Unis et d'autres régions.
Lignes directrices : L ICH formule des lignes directrices harmonisées pour diverses facettes du développement pharmaceutique, y compris les protocoles d'étiquetage.
ICH Q3CICH : cette ligne directrice formule des recommandations pour l'élaboration et la justification de l'étiquetage et des notices d'emballage Produits médicaux destinés à l'usage humain.
Autres autorités réglementaires régionales
Plusieurs organismes réglementaires régionaux publient leurs propres directives spécifiques relatives artwork pharmaceutiques, qui s'alignent souvent sur les principes établis par les autorités ou y font référence. Parmi les exemples notables, on peut citer :
- Administration nationale des produits médicaux de ChineNMPA
- Agence japonaise des produits pharmaceutiques et des dispositifs médicauxPMDA
- Health Canada
Quelles sont les principales réglementations et normes applicables aux Artwork pharmaceutiques ?
Des réglementations et normes importantes régissent artwork pharmaceutiques artwork garantir leur conformité aux exigences réglementaires et artwork promouvoir la sécurité des patients. Voici les principales réglementations et normes applicables aux artwork pharmaceutiques :
Réglementation de FDA en matière d'étiquetage (États-Unis)
- Code des réglementations fédérales (CFR) Titre 21, parties 201 et 314 : Définit les exigences en matière d'étiquetage pour les médicaments sur ordonnance et en vente libre, y compris les spécifications relatives au contenu, au format et à l'emplacement des informations sur les étiquettes et les emballages.
Règlement d'étiquetage de l'EMA (Union européenne)
- Règlement (CE) n° 726/2004 de la Commission : Définit les exigences en matière d'étiquetage Produits médicaux usage humain dans l'UE, couvrant des aspects tels que le contenu, la présentation et les exigences linguistiques.
- Lignes directrices sur l'Labelling Produits médicaux l'usage humain : Fournit des directives détaillées sur le contenu et le format des étiquettes, y compris les exigences en matière de lisibilité et de clarté.
Lignes directrices de ICH
- ICH (Qualité des produits biotechnologiques : essais de stabilité des produits biotechnologiques/biologiques) : Guide la conception et le contenu des notices d'emballage des produits biotechnologiques, y compris les considérations relatives à artwork.
- ICH (R2) Développement pharmaceutique : Propose des principes pour le développement pharmaceutique, y compris des considérations relatives à l'étiquetage et artwork du cycle de vie du produit.
Normes ISO
- ISO 11607 (Emballage des dispositifs médicaux stérilisés en phase terminale) : Spécifie les exigences relatives à la conception, à la validation et à l'étiquetage des emballages des dispositifs médicaux stérilisés en phase terminale, afin de garantir leur sécurité et leur efficacité.
- ISO 13485 (Dispositifs médicaux - Systèmes de gestion de la qualité) : Définit les exigences relatives aux systèmes de gestion de la qualité dans la conception et la fabrication des dispositifs médicaux, y compris les considérations relatives à l'étiquetage.
Normes de la pharmacopée
- Pharmacopée des États-Unis (USP) : Fournit des normes pour l'étiquetage, l'emballage et le stockage des produits pharmaceutiques, garantissant ainsi la qualité et la sécurité des produits.
- Pharmacopée européenne (Ph. Eur.) : Contient des monographies et des lignes directrices pour l'étiquetage pharmaceutique et les matériaux d'emballage, garantissant la conformité avec les exigences réglementaires en Europe.
Lignes directrices relatives aux bonnes pratiques de fabrication (BPF)
- Réglementations GMP deFDA (21 CFR Part 210 et 211) : Spécifient les exigences relatives à la fabrication, à l'étiquetage et à l'emballage des produits pharmaceutiques afin d'en garantir la qualité et la sécurité.
- Lignes directrices de l'UE sur les BPF : Principes et lignes directrices pour la fabrication de produits pharmaceutiques, y compris les exigences en matière d'étiquetage et d'emballage afin de garantir la qualité des produits et la sécurité des patients.
Réglementations et lignes directrices nationales
- Règlements deHealth Canada : Régit les exigences en matière d'étiquetage des produits pharmaceutiques au Canada, garantissant la conformité aux normes de sécurité et d'efficacité.
- Règlements de l'Agence japonaise des produits pharmaceutiques et des dispositifs médicauxPMDA: Établissent les exigences en matière d'étiquetage et d'emballage des produits pharmaceutiques au Japon, afin de garantir la qualité et la sécurité des produits.
Le respect de ces réglementations et normes est essentiel pour les entreprises pharmaceutiques afin de garantir la conformité, de promouvoir la sécurité des patients et de faciliter l'accès de leurs produits au marché. Le respect de ces exigences permet d'atténuer les risques et de garantir la qualité, l'efficacité et la sécurité des produits pharmaceutiques.
Quel est l'impact de la non-conformité dans Artwork réglementaires Artwork
Le non-respect artwork réglementaires artwork a des implications importantes pour les entreprises pharmaceutiques, tant dans le domaine de la santé publique que dans celui des affaires. La non-conformité aux artwork réglementaires artwork des risques multiples pour les entreprises pharmaceutiques, tant sur le plan juridique, financier, opérationnel que sur celui de la réputation. Il est impératif de respecter de manière proactive les protocoles de conformité, de mettre en place des cadres d'assurance qualité solides et de faire preuve d'une vigilance réglementaire constante afin d'atténuer ces risques et de préserver l'intégrité réglementaire artwork pharmaceutiques.
Vous trouverez ci-dessous une analyse approfondie des conséquences de la non-conformité :
Préoccupations en matière de sécurité des patients
- Les écarts par rapport aux normes réglementaires dans artwork entraîner des inexactitudes ou des omissions dans les informations pharmaceutiques, ce qui augmente le risque d'erreurs de médication ou d'effets indésirables chez les patients.
- Un étiquetage ou un emballage inadéquat peut induire une confusion concernant les directives de dosage, les contre-indications ou les instructions de stockage, mettant ainsi en péril le bien-être du patient.
Pénalités et amendes réglementaires
- Les organismes de réglementation imposent des sanctions sévères en cas de non-respect artwork , notamment des amendes financières, des rappels de produits et des mesures coercitives.
- Le non-respect des critères réglementaires peut entraver l'obtention des autorisations de mise sur le marché, retarder le lancement des produits et les stratégies d'entrée sur le marché.
Atteinte à la réputation
- La non-conformité nuit à la réputation et à la fiabilité des entités pharmaceutiques, érodant la confiance des professionnels de la santé, des patients et des agences de réglementation.
- La publicité négative résultant d'infractions à la réglementation ou de rappels de produits peut avoir des effets négatifs durables sur la perception de la marque et la position sur le marché.
Responsabilité juridique et litiges
- artwork non conformes artwork les entreprises à des risques juridiques, notamment à des poursuites judiciaires et à des litiges de la part des parties concernées ou des organismes de réglementation.
- Le coût financier des frais de contentieux, des règlements et des dommages-intérêts peut entraîner des revers considérables et perturber la continuité des opérations.
Perturbations de la chaîne d'approvisionnement
- Les infractions réglementaires dans artwork entraîner des rappels de produits ou des sanctions, perturbant les chaînes d'approvisionnement et entraînant des pertes de stocks, des retards de production et des complications logistiques.
- De telles perturbations compromettent les flux de revenus, les relations avec les clients et la résilience globale de l'entreprise.
Perte d'accès au marché
- La non-conformité peut entraîner des restrictions de marché, des retraits de produits ou une perte de position sur le marché dans les juridictions concernées, réduisant ainsi les perspectives de revenus et les parts de marché.
- Reconstruire la confiance des régulateurs et rétablir la présence sur le marché après des incidents de non-conformité nécessite beaucoup de temps, de ressources et d'efforts stratégiques.
Une surveillance réglementaire accrue
- La non-conformité à la réglementation donne lieu à un examen plus approfondi, entraînant une intensification des audits, des inspections et de la surveillance de la conformité de la part des autorités réglementaires.
- Le renforcement de la surveillance réglementaire entraîne une augmentation des charges administratives, des dépenses de mise en conformité et de l'affectation des ressources à des mesures correctives.
Désavantage concurrentiel
- La non-conformité érode la compétitivité, tandis que les homologues qui respectent les règles gagnent du terrain sur le marché, de la crédibilité et la faveur des consommateurs.
- Le non-respect des critères réglementaires peut décourager les partenariats, les investissements ou le mécénat potentiels, limitant ainsi les perspectives d'expansion des entreprises.
Quels sont les défis Artwork sont confrontées les entreprises pharmaceutiques en matière d'Artwork ?
Naviguer artwork les méandres de artwork pharmaceutique artwork un environnement hautement réglementé pose des défis particuliers aux entreprises opérant dans ce secteur. Atteindre le délicat équilibre entre créativité, précision et respect des normes réglementaires exige une planification méticuleuse et des approches proactives. Voici quelques-uns des principaux obstacles rencontrés par les entreprises pharmaceutiques dans la gestion artwork:
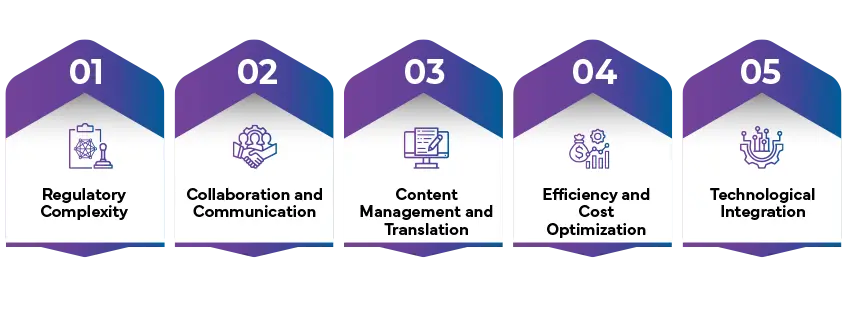
Complexité réglementaire
- Évolution constante de la réglementation : Se tenir au courant des réglementations en constante évolution dans diverses régions représente un défi de taille. Artwork respecter des critères spécifiques en matière de contenu, de format, de langue et de symbolisme, qui varient en fonction du marché visé.
- Interprétation des directives : Le décryptage et la mise en œuvre des directives réglementaires nécessitent des connaissances spécialisées et une attention méticuleuse aux détails afin d'éviter les pièges de la non-conformité.
Collaboration et communication
- Des parties prenantes aux multiples facettes : le processus artwork implique un large éventail de parties prenantes, notamment des designers, des équipes marketing, des experts en réglementation et des collaborateurs externes. Une coordination et une communication efficaces entre ces entités disparates sont indispensables pour garantir un flux de travail fluide.
- Contrôle et suivi des versions : la gestion de multiples itérations artwork des étapes de révision et d'approbation représente un défi qui nécessite des mécanismes robustes pour suivre les modifications, prévenir les erreurs et maintenir la transparence.
Gestion du contenu et traduction
- Précision et exhaustivité : garantir l'exactitude, l'exhaustivité et la cohérence de tous artwork , y compris les instructions posologiques, les avertissements et les contre-indications, est essentiel pour préserver le bien-être des patients.
- Considérations culturelles : La traduction de contenus destinés aux marchés mondiaux exige une sensibilité aux nuances culturelles et réglementaires afin d'éviter les interprétations erronées et de faciliter une communication lucide.
Efficacité et optimisation des coûts
- Procédures à forte intensité de temps : L'examen minutieux et les protocoles d'approbation imposés par les réglementations peuvent prendre beaucoup de temps, ce qui risque d'entraver le lancement des produits et d'affecter les délais d'accès au marché.
- Allocation des ressources : La gestion efficace artwork et de la révision artwork , ainsi que le respect des réglementations, nécessitent des ressources dédiées et des compétences spécialisées, ce qui a des implications financières pour les organisations.
Intégration technologique
- Compatibilité avec les systèmes existants : L'intégration des nouvelles technologies dans les systèmes existants constitue un défi, car elle peut nuire à l'efficacité des processus et à l'interopérabilité des données.
- Sécurité des données et conformité réglementaire : la mise en œuvre de mesures de sécurité des données robustes est indispensable pour protéger les données sensibles des patients tout au long du artwork et respecter les réglementations strictes en matière de confidentialité des données.
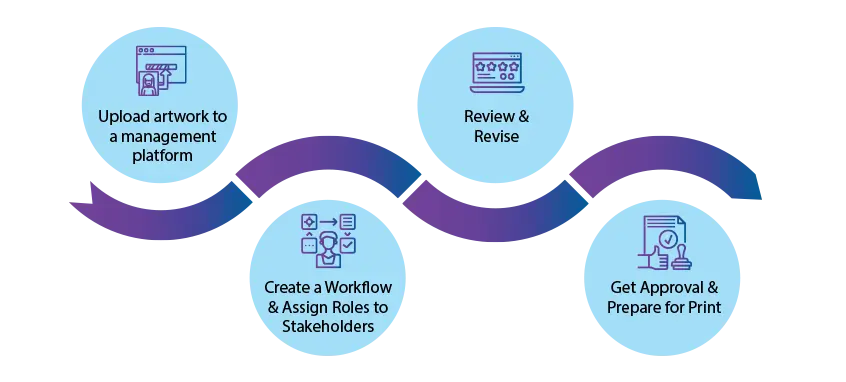
Comment votre équipe gère-t-elle Artwork ?
Le processus artwork est un processus long qui peut prendre de quelques jours à plusieurs mois. artwork et la préparation d'une seule artwork pour la production peuvent impliquer votre équipe de conception, votre service juridique et tous les autres services concernés.
Pour éviter les difficultés liées à la collecte de commentaires auprès d'équipes différentes souvent dispersées dans le monde entier, de nombreuses entreprises font appel à un logiciel d'approbation de la conception.
Voici quatre étapes qui vous aideront à transformer votre processus artwork
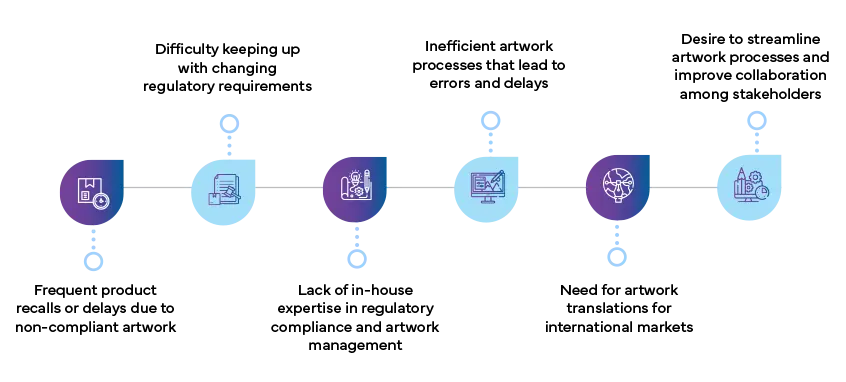
Quels sont les signes indiquant que votre entreprise a besoin d'un prestataire Artwork ?
Voici quelques signes clés qui indiquent que votre entreprise pourrait tirer profit d'un partenariat avec un prestataire artwork :
Quels sont les avantages d'un partenariat avec un prestataire Artwork ?
- Expertise en matière de conformité réglementaire : notre partenariat avec des prestataires spécialisés artwork garantit le respect des normes réglementaires rigoureuses régissant l'étiquetage, l'emballage et artwork des produits, ce qui est essentiel pour assurer la conformité légale et préserver le bien-être des patients.
- Assurance qualité rigoureuse : notre collaboration avec des prestataires artwork garantit une attention méticuleuse aux détails et à la précision, soutenue par des mesures de contrôle qualité rigoureuses comprenant une relecture approfondie, la détection des erreurs et une gestion minutieuse des révisions.
- Utilisation de technologies de pointe : l'exploitation de technologies de pointe et de capacités d'automatisation, telles que les logiciels de conception assistée par ordinateur (CAO) et les systèmes de gestion de contenu (CMS), rationalise les processus artwork , améliorant ainsi l'efficacité et les délais d'exécution.
- Adaptabilité et évolutivité : les prestataires Artwork proposent des solutions adaptables et évolutives, qui répondent à artwork variées en termes de volume et de complexité, et s'adaptent aussi bien aux projets à petite échelle qu'aux projets à grande échelle.
- Conformité mondiale et localisation : grâce à leur expertise dans la gestion artwork , les prestataires garantissent la conformité avec les spécifications linguistiques et culturelles des différents marchés, assurant ainsi l'exactitude et la cohérence des messages et du contenu.
Comment Freyr peut-il vous aider à l'échelle mondiale ?
Freyr se Freyr par une gamme complète de services réglementaires, soutenue par une équipe d'experts connaissant parfaitement les subtilités des cadres réglementaires dans les différentes juridictions mondiales. Fort d'une connaissance approfondie des réglementations telles que celles de FDA États-Unis, EMA Europe et de divers organismes réglementaires dans les pays de la région Asie-Pacifique, Freyr des solutions de conformité personnalisées, adaptées aux exigences spécifiques de chaque marché. Cela inclut des services de localisation méticuleux, garantissant que artwork est adapté aux différentes régions et langues afin de trouver un écho auprès des publics cibles à travers le monde.
De plus, l'engagement Freyr en faveur de l'excellence réglementaire s'étend au suivi continu des changements et des mises à jour réglementaires, permettant ainsi aux clients de naviguer en toute confiance dans un paysage réglementaire en constante évolution. Grâce à son réseau mondial de bureaux et de partenaires, Freyr un soutien sans faille à ses clients opérant sur divers marchés, facilitant la mise en place de stratégies réglementaires efficaces, l'obtention d'autorisations locales et artwork . En outre, Freyr la sensibilité culturelle dans artwork , en intégrant des nuances culturelles dans les supports afin d'améliorer l'acceptation et l'engagement du public local.
- Connaissance approfondie de la réglementation : Freyr dispose d'une équipe d'experts en réglementation ayant une connaissance approfondie des réglementations locales dans diverses régions. Qu'il s'agisse de la FDA aux États-Unis, de l'EMA en Europe ou des organismes de réglementation dans les pays d'Asie-Pacifique, nos experts connaissent parfaitement les subtilités de chaque juridiction.
- Solutions de conformité personnalisées : nous proposons des solutions de conformité personnalisées, adaptées aux exigences réglementaires spécifiques de chaque marché. En tirant parti de notre expertise locale, nous veillons à ce que artwork , l'étiquetage et l'emballage soient conformes à toutes les réglementations applicables, facilitant ainsi l'entrée sur le marché et les autorisations.
- Services de localisation : Freyr des services de localisation complets afin d'adapter artwork à différentes régions et langues. De la traduction de textes à l'ajustement des images et des symboles en fonction des préférences culturelles, nous veillons à ce que artwork auprès des publics cibles à travers le monde.
- Mises à jour en matière de réglementation : notre équipe surveille en permanence les changements et les mises à jour réglementaires dans différentes régions. En anticipant l'évolution des réglementations, nous aidons nos clients à s'y retrouver dans un paysage réglementaire en constante mutation et à adapter de manière proactive leurs artwork afin de rester en conformité.
- Réseau mondial : grâce à son réseau mondial de bureaux et de partenaires, Freyr un soutien sans faille à ses clients opérant sur divers marchés. Qu'il s'agisse d'établir des stratégies réglementaires, d'obtenir des autorisations locales ou de gérer artwork , notre présence locale garantit une conformité réglementaire efficace et efficiente dans le monde entier.
- Sensibilité culturelle : Conscient de l'importance de la sensibilité culturelle dans artwork , Freyr ce que les supports fournis par ses clients trouvent un écho auprès du public local. Des préférences en matière de couleurs au choix des images, nous intégrons les nuances culturelles dans artwork afin d'améliorer leur acceptation et leur impact.
Pourquoi Freyr?
Expertise réglementaire
Compte tenu des normes réglementaires strictes qui régissent artwork pharmaceutiques, il est primordial de disposer d'une expertise en matière de conformité afin de garantir le respect de la législation et la sécurité des patients.
Partenariats stratégiques
L'établissement de relations solides avec les clients favorise la collaboration et permet d'élaborer des solutions sur mesure qui répondent efficacement à des besoins spécifiques et à des objectifs à long terme.
Processus de contrôle de la qualité
Garantir l'exactitude et la précision des artwork des mesures de contrôle qualité rigoureuses permet d'éviter les erreurs et les non-conformités réglementaires.
Agilité et flexibilité
Dans un paysage réglementaire dynamique, la capacité à s'adapter rapidement aux changements est cruciale pour maintenir la conformité et répondre aux besoins changeants des clients.
Services complets
Offrirartwork end-to-end simplifie le processus pour les clients, en leur apportant un soutien à chaque étape, de la conception à la validation finale.
Intégration des technologies avancées
L'utilisation de la technologie améliore l'efficacité et la précision dans artwork , ce qui contribue à accélérer les délais d'exécution et à améliorer la qualité.
Une communication transparente
Une communication ouverte et transparente favorise la confiance et la collaboration, garantissant que les clients sont informés et impliqués tout au long du processus.
Innovation continue
L'innovation stimule le progrès et garantit que artwork restent à la pointe de la technologie, offrant des résultats optimaux aux clients dans un secteur en constante évolution.
Flexibilité et évolutivité
La capacité de s'adapter à l'évolution des besoins et de moduler les opérations en fonction des besoins garantit aux clients un service adaptable et réactif.
Formation et assistance complètes
L'acquisition de connaissances et de compétences par les clients leur permet de se conformer aux exigences réglementaires de manière indépendante, ce qui favorise l'autosuffisance et la réussite à long terme.
Le développement durable en point de mire
La responsabilité environnementale s'aligne sur les valeurs plus larges de l'entreprise et contribue à un avenir plus durable, en démontrant l'engagement envers les normes sociales et éthiques.
Questions fréquemment posées
artwork réglementaires comprennent la création, la gestion et la soumission d'emballages et d'étiquettes pharmaceutiques conformes aux normes réglementaires internationales. Ces services incluent artwork , Conformité du labelling, la localisation, la traduction, la veille réglementaire, la gestion artwork et l'assurance qualité.
Les principes GMP améliorent artwork des emballages artwork garantissant la clarté, la précision, la gestion des risques, la traçabilité et la conformité. Ces pratiques réduisent les erreurs, améliorent l'efficacité et préservent la réputation de la marque tout en garantissant la sécurité des patients.
La non-conformité peut entraîner des problèmes de sécurité pour les patients, des sanctions réglementaires, des atteintes à la réputation, des responsabilités juridiques, des perturbations de la chaîne d'approvisionnement, une perte d'accès au marché, une surveillance réglementaire accrue et un désavantage concurrentiel. Les entreprises doivent maintenir leur conformité pour éviter ces risques.
L'automatisation de artwork simplifie le processus, réduit les erreurs, garantit la cohérence et permet de gagner du temps et de réduire les coûts. Les systèmes automatisés peuvent rapidement détecter les divergences et garantir la conformité, améliorant ainsi la qualité et l'efficacité globales du processus de vérification.
La technologie blockchain est un système de registre décentralisé et distribué qui enregistre les transactions sur plusieurs ordinateurs de manière à ce que les transactions enregistrées ne puissent pas être modifiées rétroactivement. Dans le contexte des artwork réglementaires, la blockchain peut améliorer la sécurité et la traçabilité des données tout au long du artwork , favorisant ainsi la confiance et la transparence dans le cadre réglementaire.
Les normes ISO sont des lignes directrices et des exigences internationalement reconnues qui garantissent la qualité, la sécurité et l'efficacité des produits, des services et des systèmes. Dans l'industrie pharmaceutique, les normes ISO telles que ISO 11607 pour l'emballage des dispositifs médicaux et ISO 13485 pour les systèmes de gestion de la qualité jouent un rôle crucial dans le maintien de la conformité et la garantie que l'emballage et l'étiquetage répondent aux exigences réglementaires et de sécurité.
La conception de l'emballage fait référence au processus de création des éléments visuels et structurels de l'emballage des produits, y compris la conception des étiquettes, des boîtes, des bouteilles et d'autres formats d'emballage. Dans l'industrie pharmaceutique, la conception de l'emballage doit être conforme aux exigences réglementaires tout en garantissant que toutes les informations nécessaires sont communiquées aux utilisateurs finaux, y compris les instructions de dosage, les avertissements et d'autres détails essentiels du produit.
La gestion des informations produit (PIM) est un système ou un processus utilisé pour gérer et centraliser toutes les données relatives à un produit, garantissant ainsi l'utilisation d'informations précises et cohérentes sur différentes plateformes et différents supports. Dans artwork réglementaires, la PIM contribue à rationaliser le processus artwork en garantissant l'utilisation des informations produit les plus récentes et les plus précises, ce qui réduit les erreurs et améliore la conformité aux normes réglementaires.











