Regulatory Labeling Services mondiaux Regulatory Labeling Services produits pharmaceutiques
Tirez parti d'une décennie d'expertise grâce à nos Regulatory Labeling services, qui couvrent les autorisations de nouveaux produits, les soumissions aux autorités sanitaires, les post-approbations, les CMC et la gestion du cycle de vie. L'accent que nous mettons sur l'excellence mondiale et locale garantit la création et la mise à jour stratégiques de documents d'étiquetage essentiels tels que les IB, les CDS et les CCDS, garantissant ainsi la conformité et le succès de l'industrie pharmaceutique.
Parcourir les sujets
- Qu'est-ce que l'étiquetage réglementaire ?
- Pourquoi l'étiquetage réglementaire est-il important dans l'industrie pharmaceutique ?
- Quelle est la procédure d'approbation de l'étiquetage ?
- Quels sont les défis les plus courants en matière d'étiquetage réglementaire ?
- Quelles sont les principales réglementations régissant l'étiquetage des produits pharmaceutiques ?
- Comment un partenaire réglementaire peut-il aider à se conformer aux exigences en matière d'étiquetage ?
- Comment les entreprises peuvent-elles commencer à utiliser les Regulatory Labeling Services?
- Les Regulatory Labeling Services peuvent-ils contribuer à la surveillance après la mise sur le marché ?
- Pourquoi choisir Freyr?
- Nos services
Qu'est-ce que l'étiquetage réglementaire ?
Dernière mise à jour le : août 2024
L'étiquetage réglementaire des produits pharmaceutiques implique la création, l'examen et la gestion de documents critiques qui communiquent des informations essentielles sur les produits aux parties prenantes, en garantissant la conformité avec les normes réglementaires mondiales. Les principaux éléments comprennent la fiche de données de baseCDS et la fiche de données de base de l'entrepriseCCDS), dérivées de sources telles que les brochures de recherche et les données post-commercialisation. Ce processus est essentiel pour transmettre les informations relatives à la sécurité et à l'efficacité sur les étiquettes spécifiques à chaque pays et pour s'aligner sur les exigences des Health Authority (HA) .
En mettant l'accent sur l'harmonisation mondiale, l'étiquetage réglementaire pharmaceutique répond aux exigences réglementaires en constante évolution, englobant les autorisations de nouveaux produits, les demandes d'autorisation de mise sur le marché, les approbations a posteriori et la gestion du cycle de vie. La précision et l'adhésion à des directives en constante évolution sont cruciales pour un étiquetage réglementaire pharmaceutique réussi, car elles influencent l'autorisation de mise sur le marché d'un produit, son profil de sécurité et sa viabilité réglementaire globale.

Freyr, leader dans Regulatory labeling services end-to-end Regulatory labeling services end-to-end , dispose d'une équipe dédiée de plus de 180 experts mondiaux en étiquetage, excellant dans la rédaction de documents essentiels tels que les brochures d'investigation (IB), les fiches techniques de développement et les informations de sécurité de développement. L'utilisation de l'intelligence artificielle améliore la précision et accélère la mise en œuvre et la révision des fiches techniques. Grâce à un CCDS rationalisé et à des processus axés sur la précision, les services complets de Freyr répondent efficacement aux besoins dynamiques de l'industrie pharmaceutique, offrant un soutien inégalé pour Conformité du labelling la réussite réglementaire.
Pourquoi l'étiquetage réglementaire est-il important dans l'industrie pharmaceutique ?
- Assurer la sécurité des patients et la communication de l'information: L'étiquetage réglementaire est essentiel pour la sécurité des patients. Les étiquettes fournissent des informations essentielles sur l'utilisation des médicaments, les dosages, les effets secondaires et les contre-indications. Les patients, les médecins prescripteurs, les professionnels de la santé et les soignants s'appuient sur ces étiquettes pour prendre des décisions éclairées. Un étiquetage clair et précis réduit le risque d'erreurs de médication, d'effets indésirables et de mauvais usage.
Il garantit que les patients reçoivent le bon traitement et comprennent son utilisation correcte. En outre, les autorités réglementaires exigent que chaque produit pharmaceutique commercialisé soit accompagné d'un étiquetage permettant de communiquer efficacement les informations relatives au traitement. - Conformité et atténuation des risques : la conformité aux réglementations en matière d'étiquetage n'est pas une simple formalité, c'est une obligation légale. Les organismes de réglementation tels que la US and Drug Administration (FDA) US , l'Agence européenne des médicaments (EMA) et d'autres imposent un étiquetage précis et complet. Le non-respect de ces réglementations peut entraîner des amendes, nuire à la réputation de la marque et même entraîner l'arrêt temporaire des chaînes de production. Les entreprises pharmaceutiques doivent démontrer que leurs processus, méthodes, tests et équipements d'étiquetage sont capables de produire de manière constante des produits sûrs et efficaces. Un étiquetage correctement validé atténue les risques et garantit le respect des bonnes pratiques de fabrication (BPF).
- Accès au marché et harmonisation mondiale: des étiquettes bien structurées facilitent l'accès au marché mondial. Une étiquetage cohérent dans toutes les régions rationalise les processus, réduit les redondances et s'aligne sur des normes harmonisées. À mesure que les régulateurs internationaux adoptent des exigences de validation des BPF, y compris la sérialisation, les chaînes d'approvisionnement pharmaceutiques sont confrontées à une complexité croissante. Les entreprises qui accordent la priorité à Conformité du labelling la confiance, améliorent l'acceptation du marché et se positionnent pour réussir dans un environnement concurrentiel.
Quelle est la procédure d'approbation de l'étiquetage ?
Le processus d'approbation de l'étiquetage dans l'industrie pharmaceutique comporte plusieurs étapes afin de garantir que toutes les informations relatives aux médicaments sont exactes, conformes et claires pour les prestataires de soins de santé et les patients. Il commence par la rédaction du contenu de l'étiquette, qui comprend des détails sur la posologie, l'administration, la sécurité et les avertissements. Les équipes réglementaires et médicales examinent ensuite ce projet en interne pour s'assurer qu'il est conforme aux normes réglementaires locales et internationales. Une fois finalisée, l'étiquette est soumise aux autorités sanitaires pour approbation, où elle fait l'objet d'un examen rigoureux pour vérifier sa conformité aux exigences de sécurité et d'efficacité. Ce n'est qu'après avoir reçu l'approbation officielle que l'étiquette peut être utilisée pour commercialiser le médicament.
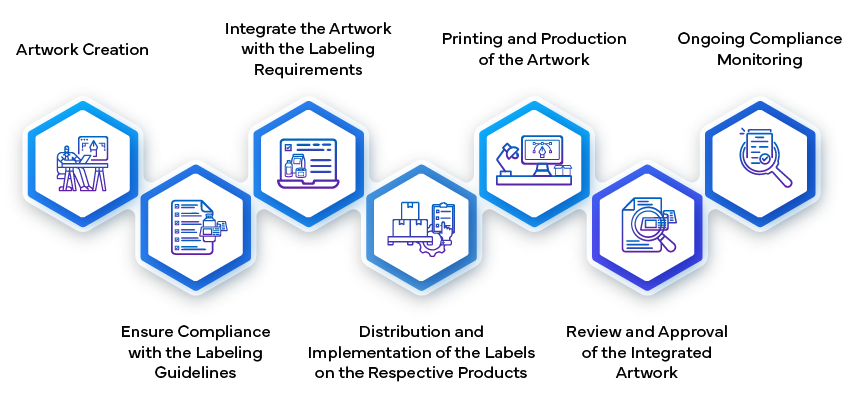
- Création et soumission de l'étiquette:
- Collecte des données initiales: Les entreprises pharmaceutiques compilent toutes les données pertinentes pour l'étiquette du médicament. Il s'agit notamment d'informations sur l'efficacité, la sécurité, les dosages, les indications, les contre-indications et les risques potentiels. L'étiquette est un outil de communication essentiel pour les professionnels de la santé et les patients.
- Soumission aux autorités réglementaires: La société soumet les données figurant sur l'étiquette aux organismes réglementaires, tels que la US and Drug Administration (FDA) US ou l'Agence européenne des médicaments (EMA). Ces organismes évaluent les données afin de s'assurer que les avantages du médicament l'emportent sur ses risques connus et potentiels pour la population visée.
- Analyse contextuelle: Les évaluateurs analysent la condition ou la maladie cible pour laquelle le médicament est destiné. Ils examinent le paysage thérapeutique existant, en mettant en balance les risques et les avantages du médicament. Par exemple, un médicament traitant une maladie mortelle pour laquelle il n'existe pas d'alternative thérapeutique peut être approuvé même si les risques seraient inacceptables pour une maladie non mortelle.
- Évaluation des données cliniques: Les examinateurs de FDA évaluent les informations sur les bénéfices et les risques cliniques soumises par le fabricant du médicament. Ils tiennent compte des incertitudes liées à des données imparfaites ou incomplètes. En règle générale, l'agence attend les résultats d'essais cliniques bien conçus pour valider l'efficacité et la sécurité du médicament.
- Création de Artwork:
- Une fois le contenu de l'étiquette approuvé, l'étape suivante consiste à créer le artwork de l'étiquette. Cela implique la conception des éléments visuels, de la mise en page, des polices et des graphiques. Le artwork être conforme aux directives réglementaires et représenter fidèlement les informations figurant sur l'étiquette.
- artwork de l'étiquette artwork examens internes au sein de l'entreprise pharmaceutique afin d'en garantir la cohérence et la conformité. Il comprend des informations telles que les instructions posologiques, les avertissements, les conditions de conservation et les coordonnées.
- artwork final artwork soumis aux autorités réglementaires pour approbation. Cette étape garantit que la présentation visuelle de l'étiquette respecte les normes de qualité et communique efficacement les informations essentielles aux utilisateurs.
- Fabrication et mise en œuvre:
- Une fois approuvée, artwork de l'étiquette artwork partie intégrante de l'emballage du médicament. Les fabricants veillent à ce que les étiquettes soient correctement apposées sur chaque unité de produit (par exemple, flacons, blisters, flacons).
- Les procédures de contrôle de la qualité permettent de vérifier que les étiquettes sont conformes aux spécifications, notamment en ce qui concerne l'exactitude du contenu, la lisibilité et le respect des lignes directrices en matière de conception.
- L'étiquette sert de pont entre l'entreprise pharmaceutique, les organismes de réglementation, les prestataires de soins de santé et les patients. Elle joue un rôle essentiel en garantissant une utilisation sûre et efficace des médicaments tout au long du cycle de vie du produit.
Quels sont les défis les plus courants en matière d'étiquetage réglementaire ?
Les défis les plus courants en matière d'étiquetage réglementaire consistent à suivre l'évolution des exigences réglementaires, à gérer l'étiquetage multilingue et à garantir la cohérence des divers portefeuilles de produits. La nature dynamique des normes réglementaires en matière d'étiquetage pharmaceutique exige une vigilance constante pour rester au fait des dernières exigences. Il est essentiel de s'adapter à l'évolution des réglementations et de mettre rapidement en œuvre les mises à jour nécessaires du contenu et du format de l'étiquetage pour maintenir la conformité et garantir la sécurité des patients.
| Défi | Description |
|---|---|
| Évolution des exigences réglementaires | Faire face à l'évolution constante des réglementations et des lignes directrices, ce qui nécessite des mises à jour constantes de la documentation relative à l'étiquetage. |
| Harmonisation mondiale | Garantir la cohérence des informations sur les produits dans les différentes régions, en s'alignant sur les exigences variées des différentes autorités sanitaires. |
| Intégration des données post-commercialisation | Gérer l'intégration des données de sécurité et d'efficacité post-commercialisation dans l'étiquetage, en veillant à l'exactitude et à la pertinence des données. |
| Respect des normes locales d'étiquetage | Respecter les normes d'étiquetage spécifiques à chaque pays, en tenant compte des variations linguistiques, culturelles et de formatage. |
| Gestion efficace du changement d'étiquetage | Rationaliser les processus de suivi, de mise en œuvre et de documentation des changements d'étiquetage de manière rapide et précise. |
L'étiquetage multilingue représente un défi de taille pour les entreprises pharmaceutiques opérant sur les marchés mondiaux. La traduction précise du contenu de l'étiquetage dans plusieurs langues, tout en respectant les nuances linguistiques et réglementaires régionales, nécessite une attention particulière aux détails et des processus de gestion de la traduction robustes. Il est essentiel de garantir la cohérence et la clarté des différentes versions linguistiques pour communiquer efficacement des informations vitales à diverses populations de patients.
Le maintien de la cohérence entre les portefeuilles de produits constitue un autre défi commun en matière d'étiquetage réglementaire. Les entreprises pharmaceutiques gèrent souvent plusieurs produits dont les exigences en matière d'étiquetage, les formulations et les indications varient. Pour assurer la cohérence et la conformité des diverses gammes de produits tout en répondant aux exigences réglementaires spécifiques à chaque produit, il est nécessaire de mettre en place des processus et des systèmes efficaces afin de garantir l'uniformité du contenu, du format et des messages de l'étiquetage.
Quelles sont les principales réglementations régissant l'étiquetage des produits pharmaceutiques ?
L'étiquetage des produits pharmaceutiques est régi par un ensemble complexe de réglementations destinées à garantir la sécurité, l'efficacité et l'utilisation correcte des médicaments. Quelques-unes d'entre elles sont énumérées ci-dessous :
FDA US FDA Agence américaine des produits alimentaires et médicamenteux)
FDA US FDA l'étiquetage des produits pharmaceutiques par le biais d'un ensemble de règles strictes énoncées dans le Code of Federal Regulations (CFR) Title 21. Ces règles exigent que les étiquettes fournissent des informations complètes, notamment les indications du médicament, les instructions d'utilisation, les contre-indications et les effets secondaires potentiels. La FDA l'importance d'un langage clair, précis et sans ambiguïté afin de garantir la sécurité des patients et la prise de décision éclairée des professionnels de santé. En outre, les exigences FDA en matière d'étiquetage s'étendent à divers aspects tels que l'emballage, les notices et l'étiquetage électronique, afin de garantir que toutes les informations sont accessibles et normalisées dans différents formats. Le respect de ces réglementations est obligatoire pour l'autorisation des médicaments et leur maintien sur le marché américain.
EMA (Agence européenne des médicaments)
L'EMA supervise l'étiquetage des produits pharmaceutiques dans l'Union européenne par le biais de directives et de lignes directrices conçues pour harmoniser l'étiquetage dans les member states. La directive 2001/83/CE de European Commission est au cœur de ces efforts, car elle spécifie les exigences relatives au résumé des caractéristiques du produitSmPC), aux notices d'information destinées aux patients et aux étiquettes d'emballage. L'EMA veille à ce que l'étiquetage contienne des informations essentielles pour les professionnels de la santé et les patients, afin de promouvoir une utilisation sûre et efficace des médicaments dans toute l'EU (European Union). En outre, l'étiquetage doit être disponible dans les langues officielles des member states où le médicament est commercialisé, ce qui reflète l'engagement de l'EMA en faveur de l'accessibilité et des soins centrés sur le patient.
TGA (Therapeutic Goods Administration)
En Australie, la TGA est chargée de réglementer l'étiquetage des produits pharmaceutiques en vertu de la loi de 1989 sur les produits thérapeutiques (Therapeutic Goods Act). Les lignes directrices de la TGA exigent que les étiquettes des médicaments fournissent des informations claires, précises et complètes sur le produit, y compris ses ingrédients, ses indications, sa posologie et ses risques potentiels. Les exigences en matière d'étiquetage visent à protéger la santé publique en veillant à ce que les consommateurs et les professionnels de la santé disposent des informations nécessaires pour utiliser les médicaments de manière sûre et efficace. La TGA met également l'accent sur la lisibilité des étiquettes, en exigeant qu'elles soient rédigées dans un anglais simple et que les informations essentielles soient mises en évidence afin d'éviter les abus et les erreurs de médication.
Health Canada
Health Canada réglemente l'étiquetage des produits pharmaceutiques dans un cadre qui donne la priorité à la sécurité et au bien-être des patients et des prestataires de soins de santé. La loi sur les aliments et drogues et ses règlements d'application définissent les exigences relatives à l'étiquetage des médicaments, qui doit comprendre des informations détaillées sur la composition du produit, ses indications, ses contre-indications et ses effets secondaires potentiels. Health Canada exige également que les étiquettes soient bilingues, c'est-à-dire présentées en anglais et en français, afin de tenir compte de la diversité linguistique du pays. En outre, Health Canada met régulièrement à jour ses exigences en matière d'étiquetage afin de tenir compte des nouvelles données scientifiques et de l'évolution des besoins en matière de santé publique, garantissant ainsi que l'étiquetage reste pertinent et efficace pour promouvoir une utilisation sûre des médicaments.
PMDA (Agence des produits pharmaceutiques et des dispositifs médicaux)
Le PMDA, l'autorité réglementaire du Japon, supervise l'étiquetage des produits pharmaceutiques conformément à la loi sur les affaires pharmaceutiques et aux directives connexes. Le PMDA exige que les étiquettes des médicaments fournissent des informations complètes, y compris les indications, les instructions de dosage et les effets indésirables potentiels, dans un format facilement compréhensible par les professionnels de la santé et les patients. La PMDA exige également que les étiquettes incluent des avertissements et des précautions spécifiques à la population japonaise, en tenant compte de facteurs tels que les différences génétiques et les pratiques culturelles. Cette approche garantit une utilisation sûre et efficace des médicaments au Japon, grâce à un étiquetage adapté aux besoins spécifiques du marché local.
NMPA (National Medical Products Administration)
En Chine, la NMPA régit l'étiquetage des produits pharmaceutiques par le biais d'un cadre réglementaire qui met l'accent sur l'exactitude, la clarté et la sécurité. La loi sur l'administration des médicaments de la République populaire de Chine définit les exigences relatives à l'étiquetage des médicaments, qui doit comprendre des informations sur les indications, la posologie, les contre-indications et les effets secondaires potentiels du médicament. Le NMPA exige également que l'étiquetage soit présenté en chinois simplifié pour garantir l'accessibilité à la population locale. En outre, le NMPA exige que les étiquettes fassent l'objet d'un examen rigoureux au cours du processus d'approbation des médicaments afin de garantir leur conformité aux normes nationales et de protéger la santé publique en évitant les erreurs de médication et le mauvais usage des médicaments.
Comment un partenaire réglementaire peut-il aider à se conformer aux exigences en matière d'étiquetage ?
Un partenaire réglementaire joue un rôle essentiel dans la mise en conformité avec les exigences en matière d'étiquetage en offrant une expertise spécialisée et un soutien complet. Il guide les entreprises à travers le paysage réglementaire complexe, en veillant à ce que les matériaux d'étiquetage, y compris les emballages, les notices et les étiquettes électroniques, respectent les exigences spécifiques des différentes autorités sanitaires telles que laFDA US , EMA, la TGA, Health Canada, PMDA et NMPA. Cela implique de comprendre et d'appliquer les dernières réglementations, qui peuvent varier considérablement d'une région à l'autre, afin de garantir que toutes les informations sur les produits sont exactes, complètes et conformes.
En outre, un partenaire réglementaire contribue à rationaliser le processus d'étiquetage en fournissant des services essentiels tels que la création, la révision et la validation du contenu. Il aide à rédiger et à réviser le contenu de l'étiquetage pour l'aligner sur les normes réglementaires et s'assurer que toutes les informations nécessaires sont incluses, depuis les listes d'ingrédients et les instructions d'utilisation jusqu'aux avertissements de sécurité et aux conditions de stockage. Cela réduit le risque d'erreurs et d'omissions qui pourraient entraîner des retards réglementaires ou des retraits du marché, accélérant ainsi la mise sur le marché de nouveaux produits.

En outre, un partenaire réglementaire aide les entreprises à maintenir une conformité permanente en surveillant les mises à jour réglementaires et en mettant en œuvre les changements nécessaires. Il offre des conseils stratégiques sur l'adaptation des étiquettes aux nouvelles directives ou aux exigences des marchés émergents, aidant ainsi les entreprises à éviter les problèmes de non-conformité et garantissant que leurs produits restent conformes aux réglementations en vigueur. En tirant parti de son expertise et en se tenant au courant des changements réglementaires, un partenaire réglementaire aide les entreprises à naviguer dans le paysage dynamique de l'étiquetage de manière efficace et efficiente.
Comment les entreprises peuvent-elles commencer à utiliser les Regulatory Labeling Services?
Pour commencer à utiliser Regulatory labeling services, les entreprises doivent d'abord évaluer leurs besoins spécifiques en matière d'étiquetage en fonction des marchés cibles et des exigences réglementaires. Ensuite, elles doivent s'associer à un prestataire de services réglementaires fiable, expert en normes d'étiquetage internationales. Ce prestataire peut les aider à rédiger, réviser et mettre à jour les étiquettes afin de garantir leur conformité. De plus, la mise en place Management du labelling centralisé Management du labelling permet de rationaliser le processus et d'assurer la cohérence de toutes les étiquettes des produits. Des audits et des mises à jour réguliers sont essentiels pour que les étiquettes restent conformes à l'évolution de la réglementation.
Évaluer les besoins en matière de réglementation :
- Identifier les exigences réglementaires spécifiques applicables à votre produit et à vos marchés cibles.
- Comprendre les documents essentiels, tels que les fiches de données de baseCDS, les brochures de rechercheIB et les exigences locales en matière d'étiquetage.
Sélectionnez un partenaire pour l'étiquetage réglementaire :
- Recherchez et choisissez un prestataire de services d'étiquetage réglementaire réputé et spécialisé dans votre secteur d'activité.
- Tenez compte de facteurs tels que l'expérience, la connaissance de la réglementation mondiale et la capacité à relever divers défis en matière d'étiquetage.
Définir la portée du projet :
- Définissez clairement la portée de votre projet d'étiquetage réglementaire, y compris le type de services requis (par exemple, IB , CCDS , Conformité du labelling ).
- Établir des calendriers, des jalons et des produits à livrer pour chaque phase du projet.
Collaborer à la collecte des données :
- Collaborez étroitement avec le partenaire que vous avez choisi pour l'étiquetage réglementaire afin de rassembler les données essentielles, y compris les informations sur les essais cliniques, les données sur la sécurité et l'efficacité, et toutes les données de surveillance post-commercialisation.
Initier la création et l'examen des documents :
- Commencer la création ou la révision des documents essentiels tels que les IB, le DCDS, le CCDS et le contenu de l'étiquetage local.
- Faciliter les révisions régulières et les sessions de retour d'information pour garantir l'exactitude et l'alignement sur les exigences réglementaires.
Mettre en œuvre des processus de contrôle des changements :
- Développer de solides processus de contrôle des changements pour étiqueter les mises à jour et suivre rapidement toutes les modifications apportées aux documents de base.
- Veiller à ce que les changements soient mis en œuvre de manière cohérente sur les étiquettes mondiales et régionales.
Contrôler la conformité :
- Mettre en place des mécanismes de contrôle permanent du respect des normes réglementaires en constante évolution.
- Rester informé des changements de réglementation et mettre à jour les documents d'étiquetage en conséquence.
Utiliser la technologie et l'automatisation :
- Tirer parti des logiciels et technologies d'étiquetage réglementaire pour améliorer la précision, l'efficacité et la gestion des documents.
- Explorer les outils qui soutiennent l'intelligence artificielle pour rationaliser la mise en œuvre des feuilles de données et les processus d'examen.
Faire appel à des experts en réglementation :
- Faites appel à des experts en réglementation ou à des consultants au sein de votre organisation ou par l'intermédiaire du prestataire de services que vous avez choisi, afin qu'ils vous donnent des informations et des conseils tout au long du processus d'étiquetage.
Amélioration continue :
- Instaurer une culture de l'amélioration continue, en révisant et en affinant régulièrement les processus d'étiquetage sur la base du retour d'information, des changements sectoriels et de l'évolution du paysage réglementaire.
Les Regulatory Labeling Services peuvent-ils contribuer à la surveillance après la mise sur le marché ?
Oui, les Regulatory labeling services peuvent en effet contribuer à la surveillance post-commercialisation des produits pharmaceutiques. Ces services jouent un rôle crucial dans la surveillance post-commercialisation en facilitant la gestion des mises à jour d'étiquetage, en gérant les modifications d'étiquetage liées à la sécurité et en garantissant la conformité avec les exigences réglementaires post-approbation. En maintenant des informations d'étiquetage précises et à jour, les Regulatory labeling services aident les entreprises pharmaceutiques à répondre aux préoccupations en matière de sécurité et à mettre en œuvre les changements nécessaires en temps voulu pour soutenir la conformité réglementaire continue et la sécurité des patients.
En outre, les Regulatory labeling services peuvent contribuer à la diffusion efficace d'informations actualisées sur la sécurité auprès des professionnels de la santé et des patients. En cas de nouvelles découvertes en matière de sécurité ou de changements dans les profils de risque des produits pharmaceutiques, les experts en étiquetage réglementaire peuvent aider à mettre rapidement à jour le contenu de l'étiquetage pour refléter les dernières données de sécurité et les exigences réglementaires. Cette approche proactive de la surveillance post-commercialisation et des mises à jour de l'étiquetage favorise la communication en temps utile d'informations importantes sur la sécurité aux prestataires de soins de santé et aux patients, contribuant ainsi à améliorer la pharmacovigilance et les soins prodigués aux patients.
Dans l'ensemble, Regulatory labeling services un soutien précieux dans le cadre de la surveillance post-commercialisation en garantissant que les produits pharmaceutiques conservent un étiquetage précis et conforme tout au long de leur cycle de vie. En tirant parti de l'expertise des professionnels de la réglementation et de l'efficacité Management du labelling , les entreprises peuvent répondre efficacement aux considérations de sécurité post-commercialisation et aux obligations réglementaires, contribuant ainsi à la sécurité et à l'efficacité continues de leurs produits sur le marché.
Pourquoi choisir Freyr?
Une décennie d'excellence en matière d'étiquetage réglementaire
Plus de 180 experts mondiaux en services d'étiquetage
Spécialisé dans la création et la gestion de documents essentiels
Expertise en matière de brochures de recherche, de fiches de données de base et de fiches de données de base d'entreprise
Engagement en faveur de la conformité et de la précision à l'échelle mondiale
Utilise l'AI (Artificial Intelligence) ) pour une navigation efficace dans la réglementation
Faits marquants
+
+
+
Questions fréquemment posées
Les fiches de données de baseCDS fournissent un résumé consolidé des informations essentielles sur les médicaments, y compris les indications, les dosages et les profils de sécurité. Elles garantissent une communication cohérente des détails essentiels sur les marchés mondiaux, facilitant ainsi le respect des réglementations et la prise de décisions éclairées. CDS servent également de référence pour la création d'étiquettes de produits locaux.
Les brochures d'investigation (IB) détaillent les données des essais cliniques et les informations relatives au développement des médicaments à des fins d'investigation, tandis que les fiches techniques de base de l'entreprise (CCDS) résument les données clés en matière de sécurité et d'efficacité à des fins réglementaires mondiales, guidant le contenu et les mises à jour des étiquettes. CCDS utilisées pour créer des étiquettes spécifiques aux produits en vue de leur autorisation de mise sur le marché.
L'intelligence artificielle améliore l'étiquetage réglementaire en automatisant l'analyse des données, en améliorant la précision de la création de contenu et en accélérant l'examen des documents. Les outils d'IA rationalisent les processus d'étiquetage et garantissent la cohérence entre les différentes exigences réglementaires. Ils aident également à prévoir et à résoudre les problèmes de conformité potentiels.
L'étiquetage multilingue garantit que les produits pharmaceutiques sont accessibles à diverses populations de patients, qu'ils répondent aux exigences réglementaires régionales et qu'ils renforcent la sécurité en fournissant des instructions et des avertissements clairs et compréhensibles dans plusieurs langues. Cela réduit le risque de mauvaise communication et d'erreurs dans l'administration des médicaments.
Management du labelling centralisé Management du labelling coordonne la création, la révision et la mise à jour des documents d'étiquetage, garantissant ainsi la cohérence et la conformité sur tous les marchés mondiaux. Il rationalise les processus et maintient des informations précises et à jour sur les produits. Ce système permet également de gérer efficacement les modifications d'étiquetage et les mises à jour réglementaires.
L'Structured Product Labeling (SPL) est un format XML utilisé pour l'étiquetage des médicaments qui normalise et organise les informations sur les produits. Il garantit la cohérence et facilite l'échange de données entre les organismes de réglementation et les fabricants. SPL permet une gestion efficace des informations d'étiquetage tout au long du cycle de vie d'un produit.
Le Global Location Number (GLN) est un identifiant unique utilisé pour identifier les lieux et les entités au sein de la chaîne d'approvisionnement. Il permet de suivre et de gérer avec précision les produits pharmaceutiques sur les marchés mondiaux. Les GLN garantissent une distribution des produits et une gestion des stocks précises et efficaces.
Le National Drug Code (NDC) est un identifiant unique pour les médicaments, attribué par la FDA. Il permet l'identification précise des produits pharmaceutiques et facilite la gestion et le suivi des stocks. Le NDC est essentiel à la précision de la distribution des médicaments et à l'établissement des rapports réglementaires.
La brochure de l'investigateurIB fournit des informations détaillées sur les données cliniques et précliniques d'un médicament expérimental. Elle sert à informer les investigateurs d'essais cliniques sur la sécurité, l'efficacité et la posologie du médicament à des fins d'étude. La brochure IB l IB investigateur soutient également la prise de décision éthique et éclairée dans le cadre de la recherche clinique.












