
Skuteczna komunikacja zawsze zapewniała bezpieczeństwo i jakość opieki nad pacjentami. Od lat istnieje niezaspokojona potrzeba zapewnienia tłumaczeń etykiet osobom, które nie posługują się biegle językiem angielskim. Zapotrzebowanie na etykiety produktów w wielu językach regionalnych wzrosło wykładniczo, ponieważ producenci farmaceutyczni zamierzają wprowadzić zmiany w kierunku lokalizacji i lepszej komunikacji.
Spełnienie tych wymagań zwiększy bezpieczeństwo pacjentów, zapewniając jednocześnie zgodność z wymogami prawnymi obowiązującymi w danym kraju. Brak ważnych informacji medycznych w regionalnych skryptach stanowi dodatkowe obciążenie dla farmaceutów i pracowników służby zdrowia, którzy muszą radzić sobie z barierą językową.
Health Products Regulatory Authority (HPRA) nadzoruje zgodność z przepisami w Irlandii. HPRA ułatwia i współpracuje z zainteresowanymi stronami, przestrzegając wytycznych dotyczących najlepszych praktyk w zakresie wielojęzycznego etykietowania wydanych przez Grupę Koordynacyjną ds. Wzajemnego Uznawania i Zdecentralizowanych Procedur - Człowiek (CMDh). Ponadto HPRA złagodziła również niektóre warunki etykietowania, które obejmują:
- Stosowanie jednostki mL Irlandii (IE) w porównaniu z ml innych państwach UE.
- Stosowanie kropek dziesiętnych w objętości lub mocy produktu oraz kropki w IE w porównaniu z przecinkiem w UE. Producenci leków mogą przezwyciężyć tę rozbieżność, grupując wymyśloną nazwę, moc i postać leku jako jedną jednostkę w każdym języku.
- Użycie separatora w sile lub objętości produktu - kropka w UE kontra przecinek w IE. Użycie przecinka jako separatora jest dozwolone na bezpośrednim opakowaniu zewnętrznym, aby uniknąć ryzyka pomyłki w irlandzkiej populacji pacjentów.
- Małe opakowania bezpośrednie, tj. pojemniki o wielkości mniejszej lub równej 50 ml, mają ograniczoną przestrzeń i mogą pomieścić minimalne wymagane informacje, w uzasadnionych przypadkach, w więcej niż dwóch (02) językach.
- Informacje z krajów trzecich - w przypadku, gdy warunki dotyczące informacji o produkcie są podobne w Wielkiej Brytanii i Irlandii, dopuszczalne są opakowania z wielu krajów. Dodatkowe wymagania specyficzne dla danego kraju są umieszczone w "niebieskiej ramce".
- Koordynacja oceny z innymi Member States Member States przeprowadzają oceny próbne, Member States zgodność oznakowania. Wnioskodawcy mogą skoordynować działania z Member States uzyskać jasność co do zmian wymaganych przed złożeniem wniosków do HPRA.
- Nazwy wspólne – Podkreślenie wymyślonej nazwy prop dla Member States zostać zgłoszone do HPRA.
HPRA przedstawia dodatkowe sugestie dotyczące wielojęzycznego etykietowania w następujący sposób:
- Informacje wymienione w języku angielskim muszą być zgrupowane w bloku.
- Wymień wymagania "blue-box" dla wszystkich krajów na tym samym panelu, jeśli kilka krajów korzysta z jednego pakietu.
- Informacje skierowane do irlandzkich pacjentów muszą być wyraźnie oznaczone owalnym kodem.
- Wnioskodawcy mogą dołączyć perforowaną sekcję na opakowaniu, pod warunkiem, że usuwalne dane nie są w języku angielskim. Należy o tym wspomnieć w zgłoszeniu.
- Wnioskodawcy muszą przesłać ulotkę w formacie PDF do HPRA na koniec procesu w celu jej aktualizacji na stronie internetowej.
Kryteria dla pakietu wielojęzycznego:
- Nazwa produktu i jego moc muszą być takie same we wszystkich językach.
- Informacje zawarte na etykiecie i ulotce dołączonej do opakowania muszą być zgodne z charakterystyką produktu leczniczego (SmPC).
- Informacje wydrukowane na etykiecie i ulotce dołączonej do opakowania muszą być dokładne i czytelne.
- Status prawny narkotyku musi być podobny w obu krajach.
Przykładem opakowania wielojęzycznego może być:
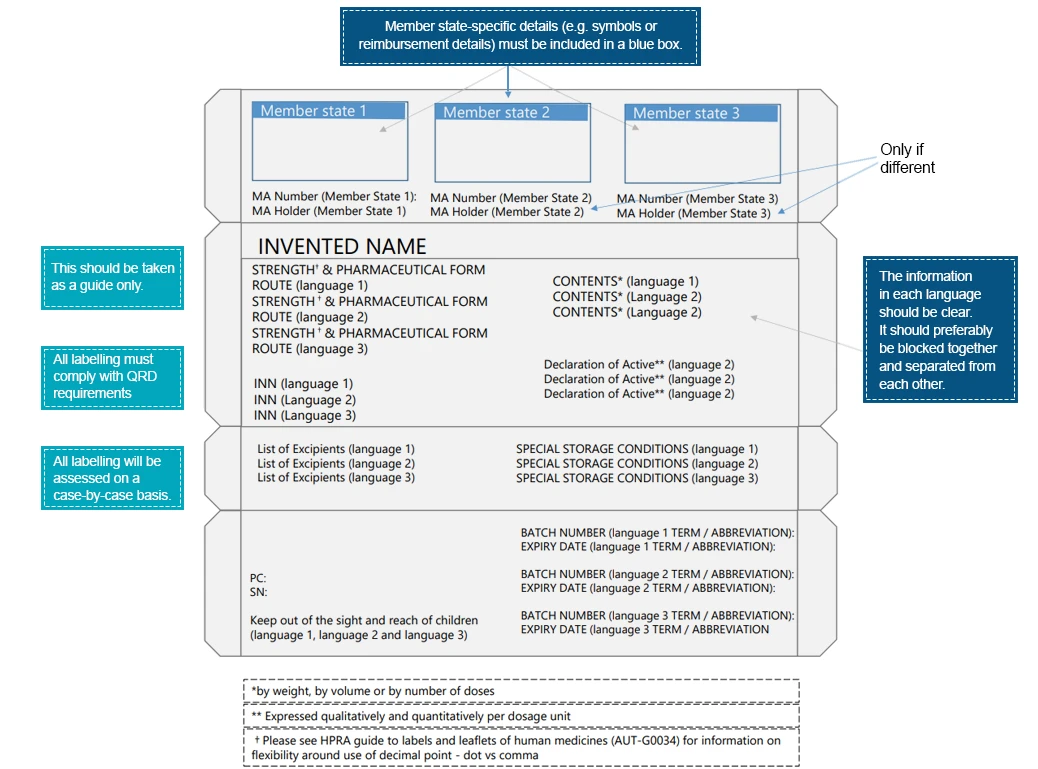
Pacjenci mają kontakt z ulotkami leków na długo przed tym, jak mają kontakt z samym lekiem. Takie interakcje jeszcze bardziej podkreślają, jak ważne jest przekazywanie kluczowych informacji za pomocą różnych elementów ulotki leku. Żeby zapewnić lepszą czytelność i ulepszyć elementy ulotki, firmy farmaceutyczne muszą podjąć niezbędne kroki. Języki regionalne stanowią środek przekazu instrukcji medycznych dotyczących produktu leczniczego, które gwarantują bezpieczne i skuteczne stosowanie przepisanego produktu. Eksperci ds. regulacji prawnych w poszczególnych krajach mogą pomóc w tłumaczeniu informacji zawartych na etykietach zgodnie z lokalnymi/regionalnymi przepisami.Eksperci Freyr są dobrze przygotowani do pomocy w wypełnianiu luk między informacjami medycznymi a językiem. Reach z us zgodnych z przepisami ścieżek etykietowania.









