
Opracowywanie i zatwierdzanie leków dla dzieci jest kluczowym aspektem opieki zdrowotnej w pediatrii. Jednak ze względu na względy etyczne i praktyczne badania kliniczne z udziałem dzieci są często ograniczone. W rezultacie etykiety leków pediatrycznych odgrywają kluczową rolę w zapewnieniu bezpiecznego i właściwego stosowania leków w tej wrażliwej grupie pacjentów. W tym blogu porównamy wymagania dotyczące etykietowania leków pediatrycznych w Unii Europejskiej (UE) i Stanach Zjednoczonych (US), aby lepiej zrozumieć podobieństwa i różnice między tymi dwoma (02) ramami regulacyjnymi.
Wymogi UE dotyczące etykietowania produktów pediatrycznych
UE ma konkretne wymagania dotyczące etykietowania Produkty lecznicze przeznaczonych dla dzieci. Wymagania te gwarantują, że leki przeznaczone dla dzieci są odpowiednio testowane, zatwierdzane i etykietowane, aby zapewnić bezpieczne i skuteczne opcje leczenia dla pacjentów pediatrycznych.
Zapewnij bezpieczeństwo leków pediatrycznych. Skontaktuj się Us
Zapewnij bezpieczeństwo leków pediatrycznych już teraz
Oto niektóre aspekty wymogów UE dotyczących etykietowania produktów pediatrycznych:
- Plany badań klinicznych z udziałem dzieci (PIP): Przed zatwierdzeniem leku dla dzieci należy przedłożyć plan badań klinicznych z udziałem dzieci (PIP) do Europejskiej Agencji Leków (EMA). Plan ten zawiera opis badań i danych wymaganych do oceny bezpieczeństwa, skuteczności i dawkowania leku w populacji pediatrycznej.
- Stosowanie u dzieci Pozwolenie na dopuszczenie do obrotu produktu leczniczego PUMA): Jeśli lek został przebadany u dzieci i spełnia wymagania, może otrzymać pozwolenie PUMA. Zezwolenie to pozwala na wprowadzenie leku do obrotu w celu stosowania u dzieci.
- Preparaty dostosowane do wieku: Leki stosowane w pediatrii powinny być dostępne w postaciach odpowiednich dla różnych grup wiekowych, takich jak płyny, tabletki do żucia lub urządzenia dozujące dostosowane do wieku.
- Charakterystyka produktu leczniczego przeznaczona dla pediatrii (SmPC): SmPC dokument zawierający szczegółowe informacje na temat leku. W przypadku produktów przeznaczonych dla pediatrii powinien on zawierać szczegółowe informacje dotyczące dawkowania, podawania i kwestii bezpieczeństwa dla różnych grup wiekowych.
- Ostrzeżenia i środki ostrożności dotyczące dzieci: Etykieta powinna zawierać wszelkie szczególne ostrzeżenia lub środki ostrożności związane ze stosowaniem leku u dzieci, takie jak potencjalne działania niepożądane lub interakcje z innymi lekami powszechnie stosowanymi u pacjentów pediatrycznych.
- Bieżące monitorowanie i aktualizacje: Po zatwierdzeniu leku do stosowania w pediatrii mogą być wymagane badania porejestracyjne w celu zebrania dodatkowych danych na temat jego bezpieczeństwa i skuteczności. W razie potrzeby mogą one prowadzić do aktualizacji etykiet.
Wymogi dotyczące etykietowania US
W US Agencja ds. Żywności i Leków (FDA) wdrożyła ustawę o równości badań pediatrycznych (PREA) oraz ustawę o najlepszych lekach dla dzieci (BPCA) w celu promowania badań nad lekami pediatrycznymi i ich oznakowaniem. PREA wymaga od firm farmaceutycznych przeprowadzania badań pediatrycznych dla niektórych leków, które mogą być stosowane u dzieci. BPCA przyznaje dodatkowe sześć (06) miesięcy wyłączności rynkowej firmom przeprowadzającym te badania.
FDA dalsze wytyczne w celu zapewnienia bezpieczeństwa, skuteczności i właściwego dawkowania leków pediatrycznych w następujący sposób:
- Plany badań pediatrycznych (PSP): Producenci muszą przedłożyć plany badań pediatrycznych w celu oceny bezpieczeństwa i skuteczności leków.
- Informacje dotyczące wieku: Etykiety powinny zawierać informacje o dawkowaniu, wskazaniach i względach bezpieczeństwa w zależności od wieku.
- Dawkowanie zależne od masy ciała: Zalecenia dotyczące dawkowania w zależności od masy ciała zapewniają dokładne podawanie.
- Działania niepożądane: Należy podać specyficzne dla pediatrii działania niepożądane i dane dotyczące bezpieczeństwa.
- Formuły specyficzne dla dzieci: Leki mogą wymagać specyficznych dla dzieci postaci dawkowania (np. płynów i tabletek do żucia).
- Inżynieria czynnika ludzkiego: Etykiety powinny uwzględniać łatwość podawania dla opiekunów.
- Ulotki informacyjne dla pacjenta: Wymagane są jasne instrukcje dotyczące podawania, dawkowania i skutków ubocznych.
Poniższa tabela przedstawia różnice i podobieństwa między wymogami dotyczącymi etykietowania obowiązującymi US Unii Europejskiej:
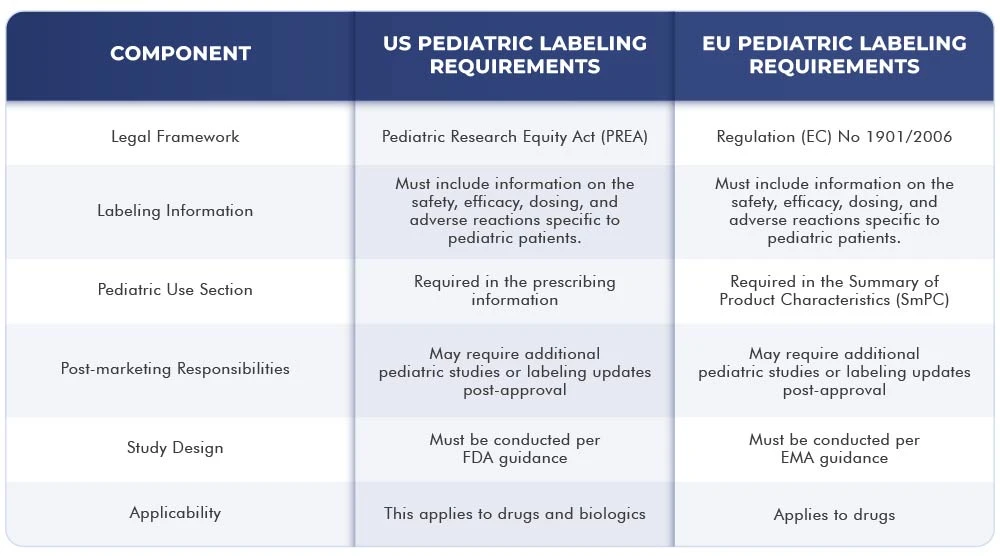
Wnioski
Wymogi dotyczące oznakowania leków pediatrycznych w UE i US zapewnienie bezpiecznego i właściwego stosowania leków u dzieci. Chociaż istnieją podobieństwa między tymi dwoma ramami regulacyjnymi, takie jak konieczność przeprowadzania badań pediatrycznych i umieszczania informacji dotyczących pediatrii na etykietach leków, istnieją również istotne różnice. Zrozumienie tych podobieństw i różnic ma kluczowe znaczenie dla firm farmaceutycznych, podmiotów świadczących usługi opieki zdrowotnej i organów regulacyjnych, aby zapewnić dzieciom dostęp do bezpiecznych i skutecznych leków.
Skonsultuj się z uznanym ekspertem w dziedzinie etykietowania, takim jak Freyr zgodności z wymaganiami dotyczącymi etykietowania obowiązującymi w poszczególnych krajach.









