
¿Sabía usted que? Se puede ahorrar hasta un millón en los próximos tres (03) años introduciendo la Garantía de Software Informático (CSA) en lugar del actual modelo de Validación de Sistemas Informáticos (CSV).
A lo largo de los años, las organizaciones farmacéuticas han incorporado el CSV, un enfoque de validación basado en el riesgo para garantizar que los sistemas operativos informáticos cumplen los requisitos reglamentarios.
Ahora que el sector se está preparando para la próxima transformación (además del enfoque basado en el riesgo), es decir, la CSA, USFDA previsto publicar nuevas directrices sobre la CSA en 2022 para ayudar a las organizaciones a comprender la calidad de los productos y el cumplimiento normativo. Se espera que las directrices proporcionen una comprensión clara de cómo, dónde y qué medidas deben adoptarse para llevar a cabo una evaluación de riesgos de software satisfactoria.
Analicemos ahora a grandes rasgos la comparación entre CSV y CSA desde el punto de vista de los procesos, las personas y la tecnología, y cómo una implantación satisfactoria de CSA puede aportar beneficios tangibles a una organización.
Proceso
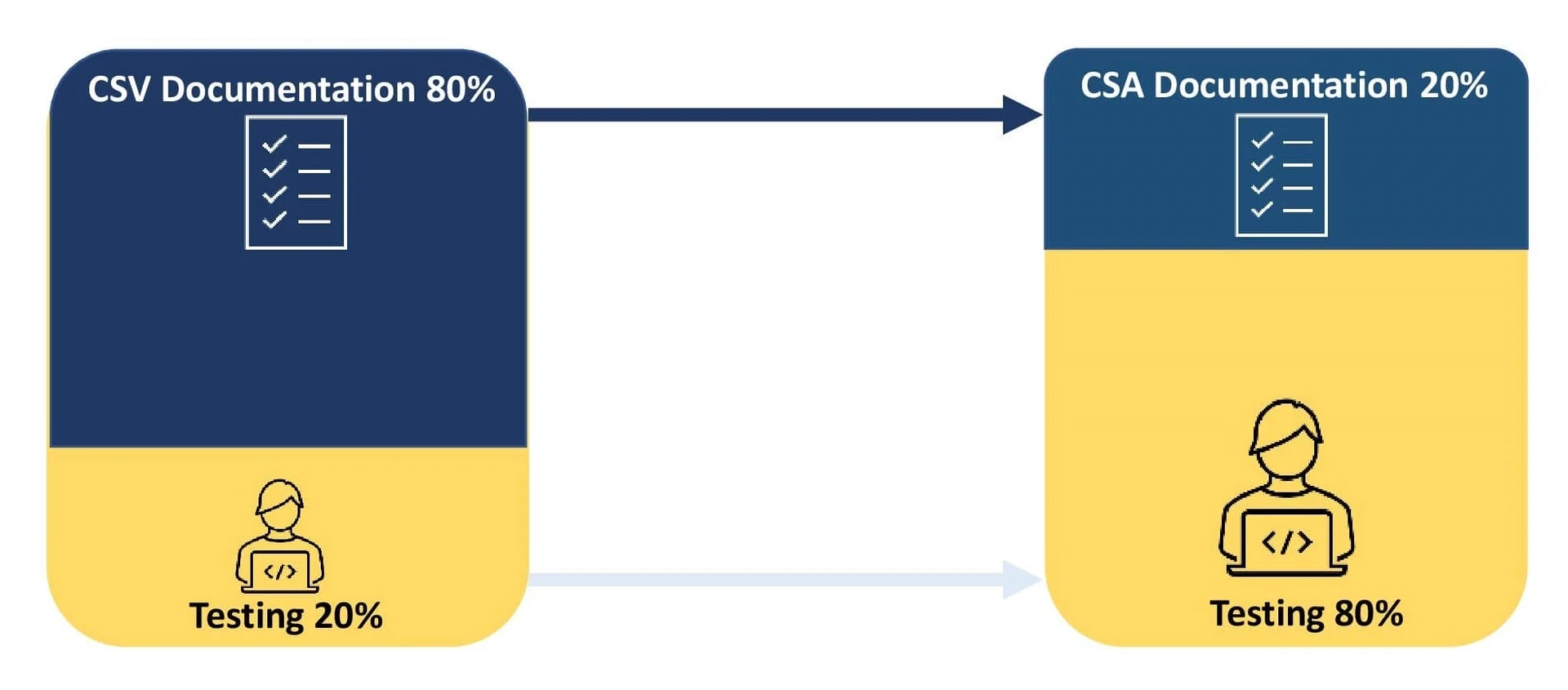
La validación de sistemas informáticos (CS V) es un enfoque documentado centrado en el cumplimiento que actúa como prueba que garantiza que el sistema es apto para el fin previsto.
Una organización invierte el 80% de su esfuerzo en la documentación del proceso de validación y el 20% en las pruebas. Cualquier discrepancia en las pruebas de CSV en relación con los resultados esperados requiere documentación y la aplicación de un plan de medidas correctoras.
La Garantía de Software Informático (CSA) es un enfoque centrado en la calidad que hace hincapié en el impacto que tiene el sistema de software en la seguridad de los pacientes, la calidad del producto y la integridad de los datos.
El objetivo principal es centrarse en la validación y documentación de las actividades que entrañan riesgos para la seguridad en función de la complejidad del software. Este enfoque fomenta el uso de la digitalización y la automatización, mejorando así la calidad del producto. La reducción del proceso de documentación ayuda a las organizaciones a reaccionar ante problemas críticos del software y a cumplir las directrices de las autoridades sanitarias. CSA aprovecha los sistemas de calidad de los proveedores para realizar pruebas sin guiones con el fin de validar sistemas de bajo riesgo, lo que permite a las organizaciones invertir el 80% de sus esfuerzos en pruebas y el 20% en documentación.
Por lo tanto, los procesos deben modificarse (enmendarse) para reflejar el enfoque CSA en las diferentes etapas del SDLC, lo que puede lograrse mediante:
- Calidad por diseño (QbD): dar prioridad a la seguridad del paciente y a la calidad del producto garantiza que el objetivo principal del sistema de software instalado sea satisfacer los requisitos del usuario para optimizar la calidad del producto.
- La estrategia de validación basada en el riesgo exige una vigilancia de las pruebas y la documentación de los sistemas propensos a fallos/defectos en los casos de riesgo directo y menor en los casos de riesgo indirecto o nulo.
- Replantearse la relación entre documentos y pruebas permite a los promotores redefinir su proceso de validación pidiéndoles que dediquen un 80% de su esfuerzo a las pruebas y un 20% a la documentación.
- Aportando beneficios tangibles al relajar la presión de la documentación.
Personas
El factor diferenciador entre CSV y CSA está en la jerarquía de la estrategia. El CSV observa la documentación seguida de las pruebas y el pensamiento crítico, mientras que, por el contrario, el CSA observa el pensamiento crítico como primer paso seguido de las pruebas y la documentación. La CSV demuestra mediante pruebas documentadas que un sistema informatizado lleva a cabo actividades de acuerdo con especificaciones y atributos de calidad previamente acordados. Por otro lado, CSA recomienda al promotor mejoras en el proceso de trazado para mitigar el riesgo y los posibles errores.
A nivel de liderazgo, amplíe el alcance del pensamiento crítico disponiendo de múltiples formas de afrontar situaciones inciertas, ya que no hay "una" forma correcta de conseguir algo. El pensamiento crítico abrirá las puertas a la innovación para desarrollar productos fiables.
A nivel práctico y de aplicación, formar a las personas y prepararlas para transformarse y adaptarse a la CSA mediante una colaboración eficaz y programas de formación efectivos.
Perspectiva tecnológica
Ya existe una guía completa sobre CSV según las autoridades reguladoras como USFDA, EMA, MHRA y muchas más. Entonces, ¿necesitamos CSA? La respuesta es sí. CSA pondrá en perspectiva el objetivo de la validación y aclarará la disparidad entre los patrocinadores y las autoridades sanitarias. Existen normativas y directrices industriales adecuadas que las organizaciones farmacéuticas deben comprender para obtener beneficios comerciales mediante la simplificación del enfoque del proceso de validación. La transición del CSV tradicional al CSA cambia la prioridad de la organización, que pasa de cumplir con los requisitos normativos a centrarse en la calidad y la seguridad de los productos. Este cambio maximiza el efecto del proceso de validación al reducir la carga de documentación, la duración de los proyectos y los costes para las empresas del sector de las ciencias de la vida.
Tanto a nivel estratégico como operativo, esto puede lograrse fomentando la digitalización y la automatización, mitigando todos los posibles riesgos y errores humanos.
Conclusión
Dado que la guíaFDA US sobre CSA aún no se ha publicado, las organizaciones farmacéuticas deben empezar a pensar de forma proactiva y a trazar protocolos para la transición de CSV a CSA. Las organizaciones deben:
- Reevaluar e identificar los sistemas que tienen un impacto directo e indirecto en la seguridad de los pacientes, la calidad de los productos y la integridad de los datos.
- Asignar recursos capaces de garantizar un cambio fluido en el proceso de validación.
- Llevar a cabo una evaluación de análisis de deficiencias con respecto al sistema existente para identificar cualquier discrepancia.
La evaluación del enfoque de validación indica qué puede hacer una organización para efectuar cambios cuando se encuentra con algún problema en el sistema. La correcta ejecución del proceso de CSV requiere un profundo conocimiento del sistema y de las formas de utilizarlo.
La necesidad actual de las organizaciones es asociarse con expertos en CSV para moderar proyectos simples o complejos y que puedan ayudar en una transición fluida de CSV a CSA. Un marco de revisión de calidad minimiza la repetición del trabajo en el proceso de validación de productos y proveedores para garantizar el cumplimiento total y la validación en cualquier etapa durante la implementación, el mantenimiento y el desmantelamiento a un precio extremadamente competitivo. Reach con Freyr el cumplimiento.









