ResumenDispositivos Médicos deDispositivos Médicos de Health Canada
Canadá, con algunas de las directrices más estrictas, cuenta con uno de los mejores sistemas reguladores del mundo para los productos sanitarios. En Canadá, todos los productos sanitarios están regulados por Health Canada, la Dirección General de Productos Sanitarios y Alimenticios, la Dirección de Productos Terapéuticos y la Oficina de Productos Sanitarios. Health Canada los dispositivos médicos para evaluar su seguridad, eficacia y calidad antes de autorizar su venta en Canadá, de conformidad con el Dispositivos Médicos de Canadá SOR/98-282, implementado en 1998. Freyr ha sido un socio activo de Dispositivos Médicos para ayudarles a cumplir con las directricesDispositivos Médicos Health Canada .
Autoridad reguladora: Health Canada
Reglamento: Reglamento sobre productos sanitarios (SOR/98-282)
Representante autorizado: No es necesario
Requisito del SGC: Cumplimiento de ISO 13485:2016 como Programa de auditoría Dispositivos Médicos (MDSAP)
Evaluación de los datos técnicos: Health Canada
Validez de la licencia: Sin límites
Requisitos de etiquetado: Parte 21 del MDR (SOR/98-282)
Formato de presentación: Papel
Idioma: Inglés y francés
Dispositivos Médicos deDispositivos Médicos de Health Canada
El sistemaDispositivos Médicos de Health Canada se basa en gran medida en la Directiva 93/42/CEE del Consejo de la Unión Europea. Muchas de las normas e interpretaciones de los términos son similares a las propuestas por la Unión Europea. Sin embargo, no siempre es cierto que un Dispositivos Médicos en una categoría según el sistema de clasificación de la Unión Europea vaya a ser clasificado en la misma categoría según el sistema Dispositivos Médicos de Canadá. El solicitante debe seguir las normas establecidas en el Reglamento para determinar la clasificación adecuada de su dispositivo en Canadá.
Para crear las normas de clasificación canadienses se utilizaron los siguientes indicadores del riesgo que plantea un determinado dispositivo: grado de invasividad, duración del contacto, sistema corporal afectado y efectos locales frente a sistémicos.
| Clase de dispositivo | Riesgo |
|---|---|
| I | Bajo |
| II | Bajo-Moderado |
| III | Alta-Moderada |
| IV | Alta |
Canadá Representante autorizado
No es obligatorio que el fabricante designe un Representante Autorizado en Canadá. No obstante, el distribuidor deberá cumplir los requisitos de Health Canada en materia de buenas prácticas de distribuciónGDP).
Dispositivos Médicos
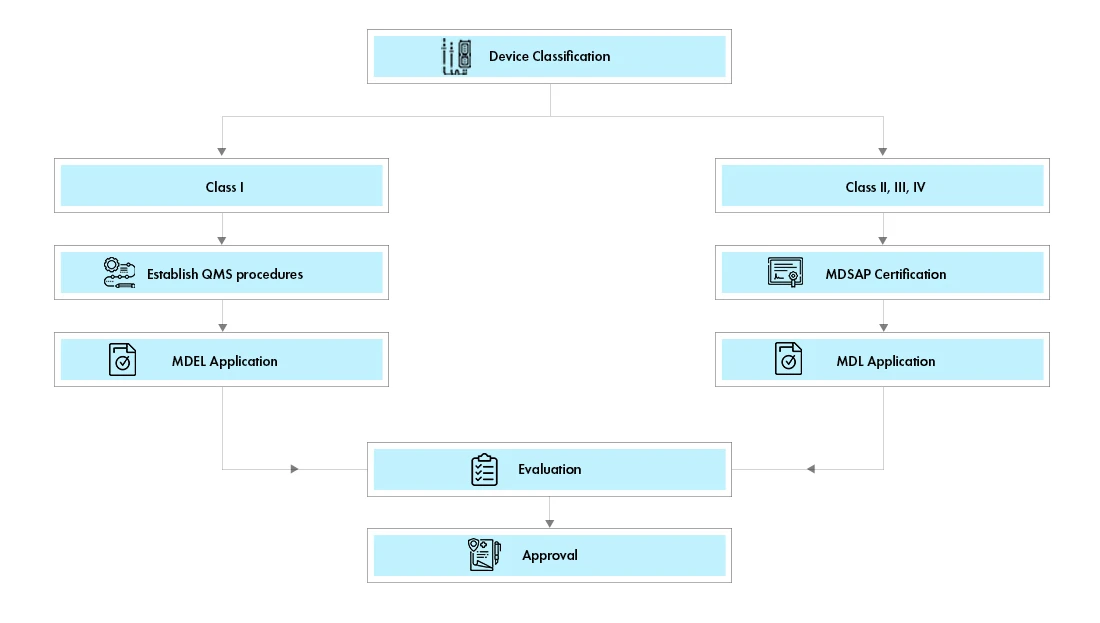
Existendos víaspara Dispositivos Médicos en Canadá:
Licencia deDispositivos Médicos (MDEL):Los dispositivos de clase I pueden solicitar la licencia Dispositivos Médicos de Canadá (MDEL) preparando los procedimientos obligatorios y pagando Health Canada .
Dispositivos Médicos (MDL):Los dispositivos de clase II, III y IV deben solicitar una Dispositivos Médicos canadiense Dispositivos Médicos (MDL). Los requisitos de documentación varían según la clase de dispositivo.
Flujo del proceso
Gestión del ciclo de vida de los dispositivos tras su aprobación
Freyr presta apoyo a fabricantes extranjeros en la gestión end-to-end Dispositivos Médicos , incluidas las actividades posteriores a la aprobación, tales como:
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes o accesorios, la incorporación de nuevas indicaciones de uso, entre otras.
- Mantenimiento de las autorizaciones y el registro mediante el pago puntual de las tasas administrativas y de registro.
- Renovación de licencias
- Enlace entre Health Canada y el fabricante
Resumen
| Riesgo | Clase de dispositivo | Auditoría del SGC | Vía reglamentaria | Requisitos de los documentos | Plazos de Health Canada |
|---|---|---|---|---|---|
| Bajo | I | NA | MDEL |
| NA |
| Bajo-Moderado | II | Certificado MDSAP | MDL |
| 15 días |
| Alta-Moderada | III | Certificado MDSAP | MDL |
| 60 días |
| Alta | IV | Certificado MDSAP | MDL |
| 75 días |
Servicios de registro Dispositivos Médicos de Freyr
Experiencia Freyr
- Health Canada Dispositivos Médicos ServiciosDispositivos Médicos y agrupación
- Dispositivos Médicos , Canadá
- Reuniones previas a la presentación con Health Canada
- MDSAP, Canadá
- Distribuidor Identificación/calificación del distribuidor para el cumplimiento de los requisitos Health Canada
- Licencia Dispositivos Médicos de Canadá (MDEL)
- Dispositivos Médicos en Canadá (MDL)
- Gestión de cambios tras la aprobación
- Servicios de etiquetado conforme a los requisitos de etiquetado de Health Canada para productos sanitarios