Protocolo y revisión de la búsqueda Dispositivos Médicos : resumen general
En el complejo ámbito de los dispositivos médicos y el diagnóstico in vitro (IVD), la importancia de un protocolo de búsqueda Dispositivos Médicos y una revisión bien estructurados Dispositivos Médicos trasciende la mera exploración investigadora. Se perfila como una piedra angular para lograr el cumplimiento de los estrictos requisitos de seguridad y rendimiento establecidos por normativas como el Dispositivos Médicos de la Unión Europea Dispositivos Médicos (EU MDR) 2017/745 y el Reglamento de la Unión Europea sobre diagnósticos in vitro (EU IVDR) 2017/746.
Revisión bibliográfica EU MDR
La revisión bibliográfica desempeña un papel crucial en la gestión del ciclo de vida de los Dispositivos Médicos. Una estrategia sistemática de búsqueda EU MDR es la base del éxito de la evaluación clínica, la evaluación del rendimiento e incluso la vigilancia poscomercialización y los informes de seguimiento clínico/de rendimiento poscomercialización. Basada en una estrategia sistemática de búsqueda bibliográfica, esta revisión no es solo una fase, sino también un faro que guía la toma de decisiones informadas.
El poder de un sólido equipo de síntesis de la literatura científica
Los fabricantes que navegan por el intrincado ámbito de los productos sanitarios y los IVD necesitan algo más que una revisión rutinaria de la bibliografía. Un sólido equipo de síntesis de la literatura científica, con experiencia en el área terapéutica, es la brújula que les guía a través del laberinto de los requisitos reglamentarios, garantizando que no solo se cumpla la normativa, sino que, de hecho, se supere.
Protocolo de búsqueda bibliográfica EU MDR
Las siguientes fases constituyen el proceso del protocolo de búsqueda bibliográfica EU MDR :
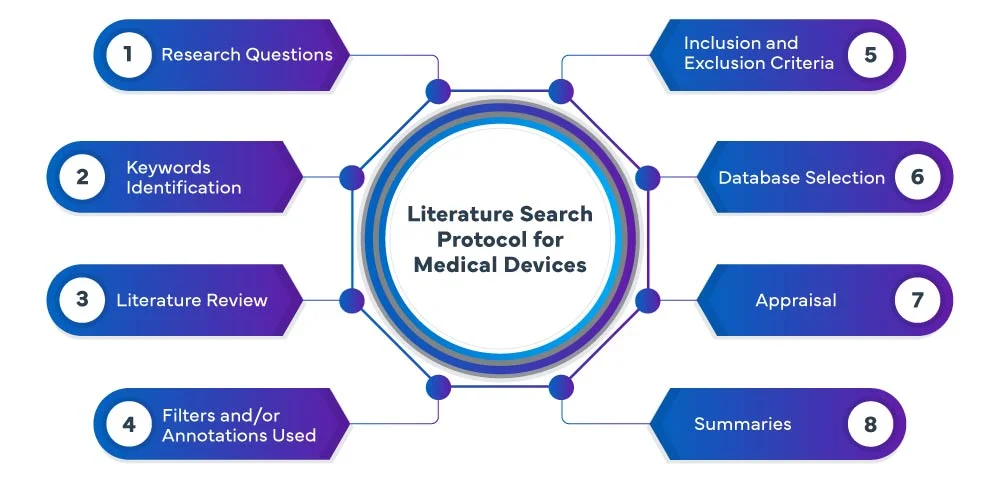
En Freyr, llevamos a cabo un protocolo de búsqueda Dispositivos Médicos sistemática y exhaustiva Dispositivos Médicos y revisamos diversas bases de datos, como PubMed, Embase y Cochrane, para identificar estudios y publicaciones relevantes relacionados con sus Dispositivos Médicos. Nuestro equipo utiliza estrategias de búsqueda avanzadas para garantizar que recopilamos toda la evidencia relevante. Analizamos y resumimos meticulosamente los resultados, proporcionándole una revisión exhaustiva que sirve de base para el proceso de desarrollo o evaluación de su dispositivo.
Somos conscientes de que cada Dispositivos Médicos único y que cada categoría de productos requiere soluciones personalizadas. Trabajamos en estrecha colaboración con usted para comprender sus necesidades y ofrecerle servicios personalizados que satisfagan sus objetivos de manera eficaz.
Protocolo y revisión de la búsqueda Dispositivos Médicos
- Identificar, buscar, analizar y reunir la bibliografía científica adecuada.
- Estrategia de las cadenas de búsqueda e inclusión/exclusión de los criterios.
- Identificación de la base de datos adecuada para el informe de búsqueda bibliográfica, según los requisitos.
- Recopilación de datos bibliográficos.
- Revisión de la bibliografía pertinente.
- Integración de los datos del PMS (si procede).
- Documentación e informes.
- Creación del Clinical Evaluation Report (CER), según la normativa EU MDR 2017/745.
- Creación de un Clinical Evaluation Plan (CEP) para su organización.
- Evaluación de las deficiencias de los PEC existentes.

- Cumplimiento garantizado de la normativa aplicable reciente.
- Un equipo de expertos clínicos cualificados.
- Escalabilidad del equipo.
- Soluciones adaptadas a sus necesidades.
- Aportaciones multifuncionales de Dispositivos Médicos para cumplir con los requisitos.
- Servicio completo de cumplimiento, revisión y planificación.





