Visión general de los servicios de cumplimiento de EU MDR
Dispositivos Médicos (MDR) de la UE entró en vigor el 26 de mayo de 2021, tras un periodo de transición de tres años y una prórroga adicional de un año debido a la pandemia de COVID-19. Los productos que se comercializan actualmente en el mercado de la UE deben cumplir con esta normativa y obtener la certificación CE según EU MDR los organismos notificados acreditados en virtud de dicha normativa. Sin embargo, los dispositivos que ya han obtenido la certificación CE según el MDD de la UE disponen de un periodo de gracia antes de tener que cumplir plenamente los EU MDR . Durante este periodo de gracia, los dispositivos certificados tanto según el MDD de la UE como según EU MDR co en el mercado con el mismo estatus y sin ser objeto de discriminación. Freyr ofrece servicios inigualables EU MDR para ayudar a Dispositivos Médicos a cumplir los EU MDR de manera oportuna.
Calendario de transición y nuevas clasificaciones de dispositivos
Dispositivos Médicos Europeo Dispositivos Médicos (MDR) entrará plenamente en vigor en todos los member states de la UE member states en los Estados de la Asociación Europea de Libre Comercio (AELC) a partir de mayo de 2021 y ofrece a los fabricantes un período de transición de cuatro años para obtener la certificación MDR completa de la UE.
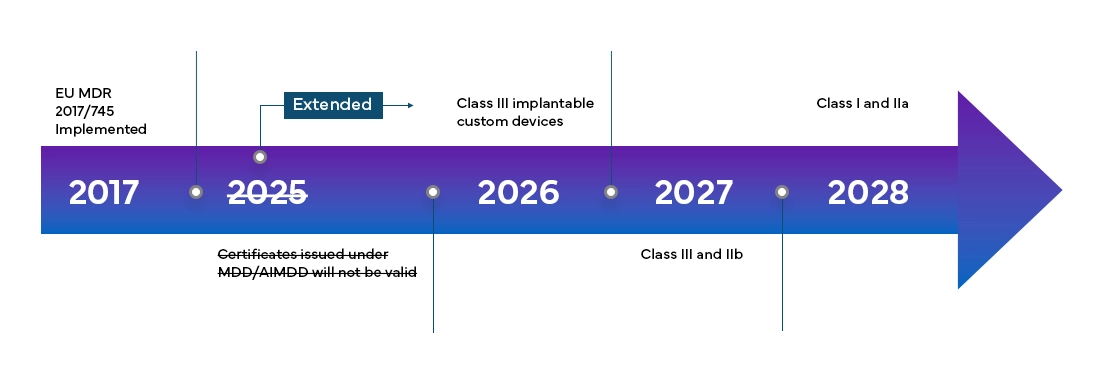
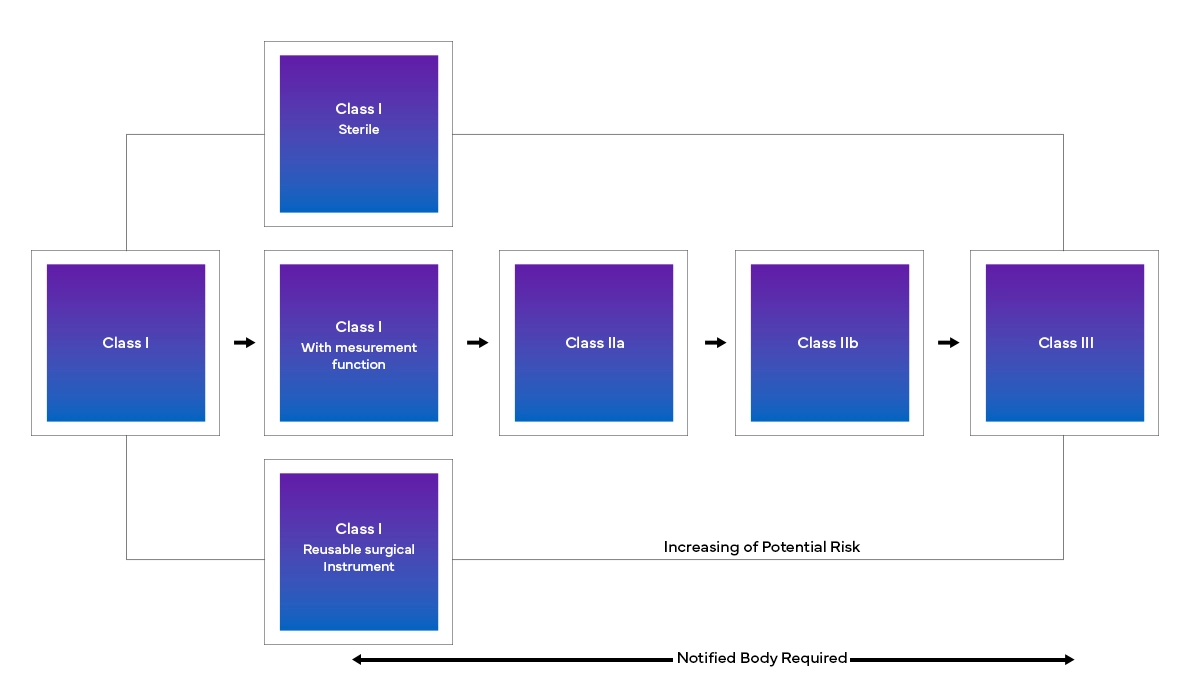
El nuevo Dispositivos Médicos Europeo Dispositivos Médicos (MDR), tal y como se ha observado, también ha introducido cambios en el sistema de clasificación de productos existente, tales como:
Desde identificar los cambios exactos que deben realizarse hasta implementarlos en tiempo real, es posible que los fabricantes tengan que superar una serie de retos para cumplir con los requisitos del MDR de la UE. Desde descifrar la nueva estructura y clasificar un dispositivo con precisión hasta recopilar y presentar todos los datos, los fabricantes necesitarán un enfoque normativo más detallado e interfuncional para hacer frente a la nueva Dispositivos Médicos europea Dispositivos Médicos . Mediante un riguroso análisis de deficiencias, Freyr ayuda a los clientes con el statu quo y les proporciona las medidas normativas necesarias para la transición y el cumplimiento del MDR de la UE.
Obtenga asesoramiento experto sobre el cumplimiento de EU MDR
Servicios de cumplimiento de EU MDR
- Desarrollo de una estrategia clara para la implementación Dispositivos Médicos (MDR).
- Comprensión de la nueva legislación, realización de análisis de deficiencias en los actuales sistemas de gestión de la calidad (SGC) y procesos en vigor
- Desarrollar un plan detallado con un enfoque multifuncional para determinar los aspectos del sistema de calidad que deberán modificarse en el ámbito de aplicación del nuevo Dispositivos Médicos de la UE Dispositivos Médicos
- Formación de varios equipos para analizar el alcance del producto, la clasificación, la gestión del SGC, etc., dentro de la organización, con un único punto de contacto en cada equipo.
- Asignación y planificación de recursos
- Considerar la interacción de su SGC con otras normativas y aprovechar esta oportunidad para agilizar los procesos, permitiendo al mismo tiempo flexibilidad para incorporar futuros cambios.
- Analizar los datos de las pruebas realizadas y comprobar si existen requisitos adicionales establecidos por MDR.
- Coordinar las expectativas y el plan de transición con los organismos notificados de la UE
- Análisis de las lagunas existentes en los productos sanitarios entre la Directiva MDD de la UE y el Reglamento EU MDR
- End-to-end para elaborar Clinical Evaluation Report (CER), incluida la búsqueda bibliográfica según las directrices Dispositivos Médicos europeo Dispositivos Médicos (EU MDR).
- End-to-end para informes de vigilancia poscomercialización (PMSR), informes periódicos de seguridad (PSUR) y resúmenes de seguridad y rendimiento clínico (SSCP).
- Aumento de los recursos reglamentarios con opciones de despliegue tanto en tierra como en el mar
- Servicios de Representante Autorizado Europeo (EAR)
- Asistencia para el cumplimiento y la presentación de MDR a los organismos notificados
- Información reglamentaria sobre el proceso de importación de los distintos mercados regulados
- Cumplimiento del SGC y simulacros de auditorías
- Sistema y herramienta de gestión de documentos para empresas MDR
- Clasificación y reclasificación de los productos en función de su riesgo
- Implantación de UDI y consultoría
- Servicios de vigilancia poscomercialización conformes con Dispositivos Médicos de la UE
- Gestión de riesgos Consultoría ISO 14971
- Formación interna y en línea
- Persona responsable de los servicios y la asistencia en materia de cumplimiento de la normativa
- Identificación de los organismos notificados MDR

Para obtener asistencia end-to-end sobre el Reglamento sobre dispositivos médicos ( EU MDR, reach con Freyr
Solicitud deEU MDR end-to-end sobre el Reglamento sobre dispositivos médicos (EU MDR




