Dispositivos Médicos Productos Dispositivos Médicos Descripción general
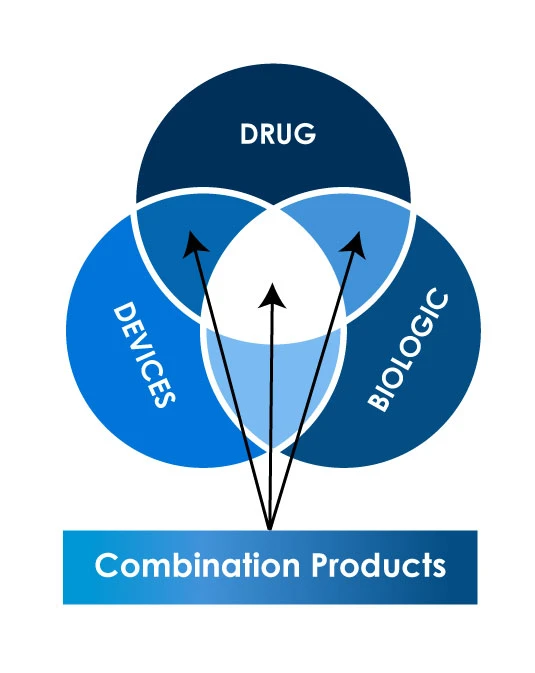
En el dinámico mundo de la asistencia sanitaria y la innovación, los productos Dispositivos Médicos se han convertido en un sólido puente que conecta los productos farmacéuticos, los dispositivos médicos y los productos biológicos. El mercado de los productos combinados está en rápida expansión, con una tasa de crecimiento anual compuesta (CAGR) prevista del 8,9 % entre 2023 y 2030. El sector de los productos combinados de medicamentos y dispositivos está preparado para un crecimiento sostenido, impulsado por los avances tecnológicos, la mejora de las infraestructuras sanitarias, la simplificación de los trámites reglamentarios, las colaboraciones estratégicas y el compromiso con una atención centrada en el paciente.
Diferentes tipos de productos combinados
Escenario normativo mundial para el registro de productos combinados
La interpretación de lo que constituye un producto combinado puede diferir de una nación a otra, lo que complica el registro de tales productos en diversos países. Además, las exigencias y procedimientos reglamentarios para los productos combinados pueden presentar variaciones en cuanto a documentación, comunicación y validación. El panorama normativo para el registro de productos combinados puede diferir significativamente en todo el mundo. Estas son las principales autoridades reguladoras who supervisan estos dispositivos en todo el mundo.
| País | Agencia | Centros principales para la aprobación |
|---|---|---|
| EE. UU. | Oficina de Productos Combinados (OCP) | Centro de Evaluación e Investigación de Medicamentos (CDER) |
| Centro de Evaluación e Investigación Biológica (CBER) | ||
| Centro de Dispositivos y Salud Radiológica (CDRH) | ||
| UE | Organismos notificados (ON) | Autoridad nacional competente (medicamentos) |
| Organismos notificados (ON) (productos sanitarios) | ||
| Japón | División de Evaluación y Licencias o Oficina de Dispositivos Médicos Médicos/Productos Dispositivos Médicos y Tisulares de la Dirección General de Seguridad de Medicamentos y Alimentos | Director de la División de Evaluación y Autorización (DMDL), Oficina de Seguridad Farmacéutica y Alimentaria, Oficina de Seguridad Farmacéutica y Médica, Ministerio de Sanidad y Bienestar Social |
| China | Centro de Administración Dispositivos Médicos (CMDSA) | Centro de Dispositivos Médicos (CMDE) |
| Centro de Evaluación de Medicamentos (CDE) | ||
| Malasia | Agencia Nacional de Reglamentación Farmacéutica | Agencia Nacional de Reglamentación FarmacéuticaNPRA) |
| Dispositivos Médicos |
El registro de productos combinados en los mercados internacionales requiere un enfoque a medida, que implica una estrecha colaboración con las Agencias Sanitarias pertinentes para su aprobación. El proceso típico de registro de productos combinados incluye los siguientes pasos:
- Evaluar si un dispositivo específico cumple los criterios para ser clasificado como producto combinado.
- Categorizar los dispositivos en función de los riesgos asociados.
- Identificar las normas pertinentes y los requisitos previos de datos especificados por la Agencia Sanitaria correspondiente.
- Generar los datos necesarios según lo dispuesto por la Agencia.
- Elaborar un expediente técnico de acuerdo con los requisitos específicos de cada país.
- Presentar la solicitud y atender cualquier consulta o duda hasta obtener la aprobación.
- Gestión del ciclo de vida del dispositivo tras su homologación.
Nuestras competencias
- Análisis inicial de riesgos
- Estudios de mercado - Información sobre productos específicos
- Aumento de personal
- Proyecto de estrategia reglamentaria
- Mercados y rutas potenciales
- Expediente de diseño y análisis de riesgos
- Quality Management System (QMS) ISO 13485
- Programa de auditoría Dispositivos Médicos (MDSAP)
- Preevaluación del SGC ISO 13485
- Estrategia normativa
- Freyr IMPACT (Plataforma de Inteligencia Reguladora)
- Verificación y validación del diseño
- Gestión de riesgos
- Proyecto de documentación técnica
- Estrategia normativa
- Requisitos reglamentarios
- Herramienta Freyr rDMS (Sistema de Gestión de Datos/Documentación)
- Validación clínica y de procesos
- Etiquetado final y artwork
- Representación en el país
- Presentación reglamentaria
- El marcado "Conformité Européenne" (CE) de la Unión Europea (UE) y el marcado "UK Conformity Assessment" (UKCA)
- Certificación de acceso al mercado mundial
- Apoyo a las auditorías de Organismos Notificados (ON)/Organismos Aprobados
- Representación en el país
- Autorizaciones reglamentarias
- Post-market Surveillance (PMS)
- Seguimiento clínico postcomercialización (PMCF)
- Mantenimiento anual del expediente técnico (CER/Gestión de riesgos)
- Renovaciones reglamentarias
- Nuevos mercados
- Comunicación Autoridad Competente/Organismo Notificado/Aprobado
- Soluciones automatizadas de farmacovigilancia (FV)
¿Por qué Freyr?
Dispositivos Médicos
- Estrategia reguladora global para productos combinados.
- Apoyo normativo para documentos de desarrollo de productos, como los archivos de historial de diseño (DHF).
- Estrategia de cumplimiento del SGC.
- Cumplimiento de la normativa, análisis de deficiencias y corrección de documentos técnicos y sistemas de calidad.
- Servicios de etiquetado reglamentario y redacción técnica.
- Servicios de regulación e inteligencia de mercado.
- Servicios de traducción de documentos y etiquetas.
- Enlace y servicio de la Agencia Sanitaria.
- artwork normativo.
- Servicios de farmacovigilancia y PMS.
- Servicios editoriales.
- Servicios de redacción médica.

- Presentaciones satisfactorias de varias clases de DIV.
- Personal dedicado y experto para proporcionar asistencia en materia de normativa sobre Dispositivos Médicos productos sanitarios para diagnóstico in vitro.
- Presentación puntual de los resultados.
- Acceso de las filiales locales para responder a los retos de la Autoridad y a los requisitos lingüísticos específicos.
- Apoyo en el país o de un representante legal con un modelo rentable.
- Gestión de recursos reglamentarios/Servicios de aumento de personal.





