Servicios de conformidad, auditoría y validación - Panorama general
¿Cumple con la normativa? Esta es una pregunta difícil de responder para cualquier empresa farmacéutica, biotecnológica, genómica, química, Dispositivos Médicos y de gestión de la cadena de suministro. Estas organizaciones deben cumplir con estrictos requisitos de calidad, seguridad y cumplimiento normativo en cada zona geográfica en la que se distribuyen sus productos. La tendencia actual en la gestión del cumplimiento normativo se orienta hacia la armonización global de la calidad y la seguridad. Tanto si es fabricante como proveedor, la expansión de su mercado, la mejora continua y la satisfacción de sus clientes dependen principalmente de los estándares de calidad de su negocio. El Centro de Excelencia (CoE) de Cumplimiento Normativo, Auditoría y Validación de Freyr puede ayudarle en esta tarea, prestándole servicios profesionales de cumplimiento, auditoría y validación para las industrias farmacéutica, de dispositivos médicos, de consumo y sanitaria, tales como cGMP (Buenas Prácticas de Fabricación), GCP (Buenas Prácticas Clínicas), GDP Buenas Prácticas de Distribución), buenas prácticas de laboratorio (GLP), buenas prácticas de farmacovigilancia GPVP ) y validación de sistemas informáticos GxP (CSV).
Freyr ofrece servicios de cumplimiento normativo, auditoría y validación que implican la evaluación de sus requisitos y la sugerencia de aportaciones a los procesos empresariales diseñados para garantizar la satisfacción del cliente. Con nuestras estrategias de preparación y preparación de informes de auditoría de cumplimiento, proporcionamos informes de cumplimiento y auditoría (análisis de deficiencias), incluyendo sugerencias de Acciones Correctivas y Preventivas (CAPA) para evitar posibles 483 y hallazgos de auditoría de cumplimiento de los reguladores.
Proporcionamos servicios de cumplimiento normativo y validación para garantizar que todos sus procesos y productos se ajustan a los requisitos aplicables en materia de calidad, seguridad de la información y auditoría de cumplimiento normativo, como los siguientes (aunque sin limitarse a ellos):
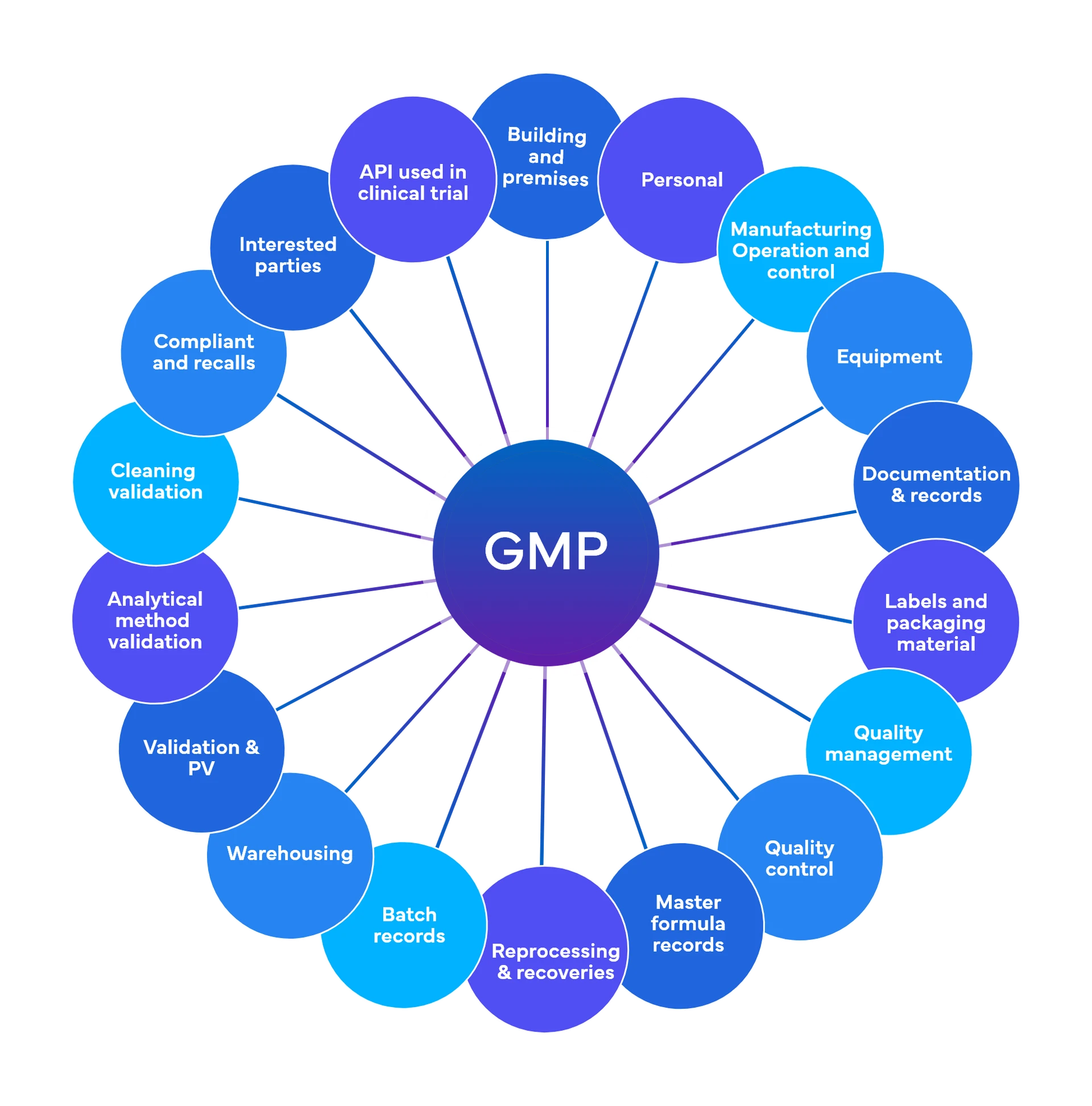
Freyr realiza unos 700 controles a nivel preliminar repartidos entre 18-19 áreas funcionales de BPF
Cumplimiento, auditoría y validación de Freyr
Servicios de conformidad, auditoría y validación
Calidad y cumplimiento de la normativa - Buenas prácticas de fabricación actuales (cGMP)
- ISO / IEC 17025: 2017 - Requisitos generales para la competencia de los laboratorios de ensayo y calibración.
- OCDE (Organización de Co y Desarrollo Económicos) - Directrices de Buenas Prácticas de Laboratorio
- Guía EURACHEM / CITAC: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3.ª edición (2016), debe seguirse en los procedimientos analíticos
- 21 CFR 58: Buenas prácticas de laboratorio para estudios de laboratorio no clínicos
- Guide to UK GLP Regulations, febrero de 2000 (por GLPMA)
- Manual de Buenas Prácticas de LaboratorioGLP) WHO : Prácticas de calidad para la investigación y el desarrollo no clínicos regulados
- Health Canada: Documento de orientación finalizado - Datos de estudios de laboratorio no clínicos en apoyo de solicitudes y presentaciones de medicamentos: Cumplimiento de las buenas prácticas de laboratorio
- Normas OSHA (Administración de Seguridad y Salud en el Trabajo)
- Directrices ICH aplicables
Buenas prácticas de laboratorio
- ISO / IEC 17025: 2017 - Requisitos generales para la competencia de los laboratorios de ensayo y calibración.
- OCDE (Organización de Co y Desarrollo Económicos) - Directrices de Buenas Prácticas de Laboratorio
- Guía EURACHEM / CITAC: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3.ª edición (2016), debe seguirse en los procedimientos analíticos
- 21 CFR 58: Buenas prácticas de laboratorio para estudios de laboratorio no clínicos
- Guide to UK GLP Regulations, febrero de 2000 (por GLPMA)
- Manual de Buenas Prácticas de LaboratorioGLP) WHO : Prácticas de calidad para la investigación y el desarrollo no clínicos regulados
- Health Canada: Documento de orientación finalizado - Datos de estudios de laboratorio no clínicos en apoyo de solicitudes y presentaciones de medicamentos: Cumplimiento de las buenas prácticas de laboratorio
- Normas OSHA (Administración de Seguridad y Salud en el Trabajo)
- Directrices ICH aplicables
Buenas Prácticas Clínicas (BPC) y Buenas Prácticas de Farmacovigilancia (BPF)
- Directriz tripartita armonizada ICH : Guía de Buenas Prácticas Clínicas - E6
- E2B(R3) Especificación del Informe de Seguridad de Caso Individual (ICSR) y archivos relacionados
- E2C(R2) Informe periódico de evaluación de prestaciones y riesgos (PBRER)
- Otras directrices ICH aplicables
- Módulos de las Directrices sobre Buenas Prácticas de Farmacovigilancia (BPF)
- Requisitos de información de seguridad de FDA para IND y estudios BA/BE
- Informes de seguridad posteriores a la comercialización de medicamentos y productos biológicos de uso humano, incluidas las vacunas
- Especificaciones de aplicación regional de FDA para la notificación de ICH E2B(R3) al Sistema de Notificación de Reacciones Adversas FDA (FAERS)
- Presentación en formato electrónico - Preguntas y respuestas técnicas sobre los ICSR no editados posteriores a la comercialización
- Planificación de la farmacovigilancia E2E
Seguridad de la información, privacidad de los datos y validación de sistemas informáticos (CSV)
- ISO 27001: 2013 Tecnología de la información - Técnicas de seguridad - Sistema de gestión de la seguridad de la información - Requisitos.
- ISO 27002: 2013 Tecnología de la información - Técnicas de seguridad - Código de buenas prácticas para la gestión de la seguridad de la información
- USFDA 21 CFR Part 11: Registros electrónicos; Firmas electrónicas - Alcance y aplicación
- Anexo 11 de la Guía de Buenas Prácticas de Fabricación de la UE
- Notificación japonesa de directriz ERES nº 0401022
- GAMP 5: Un enfoque basado en el riesgo para sistemas informatizados GxP conformes
- USFDA - Directrices de validación de software
- Directrices ICH QSEM aplicables
- Planificar y crear procedimientos normalizados de trabajo y controlar las instalaciones de fabricación
- Modelo de proceso integrado
- Mantener la imagen de marca
- Servicios de evaluación de riesgos
- Ahorro global de costes
- Implantar procesos empresariales eficaces y conformes
- Establecimiento de estrategias de validación y cualificación
- Experiencia en cumplimiento de la normativa y auditoría
- Auditores expertos en cumplimiento de la normativa


 Servicios de cumplimiento y auditoría
Servicios de cumplimiento y auditoría







