Clinical evaluation report (CER) de productos sanitarios Descripción general
Todo producto destinado a comercializarse en la Unión Europea (UE) debe llevar el marcado CE. De acuerdo con el EU MDR 2017/745 de EU MDR , los requisitos para un Clinical Evaluation Report (CER), incluidos los requisitos de procesos y datos, varían en función de la clase de un producto y son necesarios para obtener la certificación CE de productos sanitarios. Los productos de la clase I de bajo riesgo pueden llevar a cabo la autocertificación CE. Por el contrario, los productos de otras clases (IIa, IIb, III) deben tramitar la certificación de la marca CE a través de un Organismo Notificado (ON) acreditado. El fabricante debe presentar el expediente técnico CE al ON para su evaluación y emisión de la aprobación de la marca CE y la emisión del certificado CE. El Clinical Evaluation Report (CER) para productos sanitarios debe presentarse junto con el Expediente Técnico CE para cumplir con los requisitos de marcado CE.
El Clinical Evaluation Report (CER) para productos sanitarios es uno de los informes que deben presentarse junto con el Expediente Técnico CE para cumplir los requisitos del CER.
¿Qué es un Clinical Evaluation Report (CER)?
La redacción del informe de evaluación clínica incluye la valoración y el análisis de los datos clínicos relativos a un Dispositivos Médicos verificar su seguridad y rendimiento clínicos. La evaluación clínica de los dispositivos médicos se basa en el análisis exhaustivo de los datos clínicos previos y posteriores a la comercialización relevantes para el uso previsto. El informe de evaluación clínica incluye datos específicos del dispositivo, así como cualquier dato relacionado con los dispositivos que el fabricante afirma que son equivalentes.
Un informe de evaluación clínica consta de literatura científica y datos clínicos analizados que se recopilaron a partir de una investigación clínica de su dispositivo o de los resultados de otros estudios sobre dispositivos sustancialmente equivalentes. El CER de un Dispositivos Médicos que el dispositivo cumple su finalidad prevista sin exponer a los usuarios y pacientes a riesgos adicionales.
El RCE EU MDR debe actualizarse cada año. En caso de que el producto se comercialice durante un período significativo y se haya demostrado su seguridad sin riesgos significativos, el CER puede actualizarse cada 2-5 años. Cualquier cambio realizado en el diseño del producto y cualquier información nueva procedente de los datos de la PMS podría dar lugar a una actualización del informe CER.
La evaluación clínica de los productos sanitarios, enmarcada en el Clinical Evaluation Report (CER), se basa en los factores que se enumeran a continuación.
- Literatura científica disponible en la actualidad; y/o
- Investigaciones clínicas realizadas
- Si la demostración de la conformidad con los requisitos esenciales basada en datos clínicos no se considera apropiada.
Etapas de la redacción de Clinical Evaluation Report (CER)
En referencia al nuevo Reglamento de Productos Sanitarios de la UE (MDR) - 2017/745, hay cuatro (04) etapas diferentes para realizar una evaluación clínica de Productos Sanitarios para preparar un Clinical Evaluation Report (CER) MDR de la UE completo.
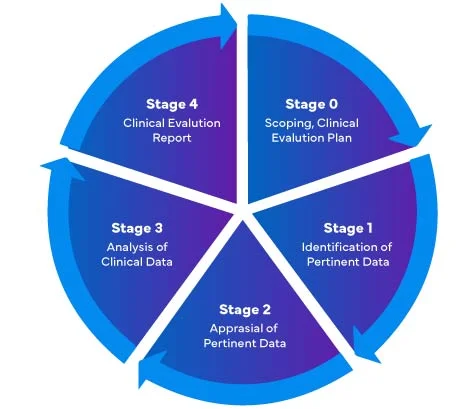
Dispositivos Médicos que accedan al mercado de la UE por primera vez deben asegurarse de que su informe de evaluación clínica cumple con la EU MDR .
Freyr servicios end-to-end de certificación end-to-end a fabricantes de dispositivos, incluida la redacción de informes de evaluación clínica de conformidad con el nuevo Reglamento EU MDR . Con una sólida experiencia regional en productos sanitarios de la UE, Freyr a los requisitos de cada organismo y personaliza el informe de evaluación clínica en consecuencia.
Clinical evaluation report (CER)
- Asistencia en la redacción de informes de evaluación End-to-end , incluida la búsqueda de bibliografía, de conformidad con la norma MEDDEV 2.7/1, revisión 4, y las directrices Dispositivos Médicos de la UE Dispositivos Médicos (MDR).
- Elaboración de un plan de evaluación clínica para su organización.
- Identificar, buscar, analizar y reunir la literatura científica apropiada aplicable.
- Desarrolle una plantilla de Informe de Evaluación Clínica para su organización.
- Análisis de carencias para el informe de evaluación clínica existente.
- Herramienta DMS para que su equipo contribuya colectivamente a la redacción del Informe de Evaluación Clínica.
- Integración de datos PMS.
- Desarrolle un procedimiento operativo estándar para que su equipo recopile datos de PMS para actualizar los Informes de Evaluación Clínica.
- Gestión de las actualizaciones periódicas de los Informes de Evaluación Clínica existentes, según las directrices MDR de la UE.
- Soporte de datos PMS para los dispositivos existentes en el mercado.
- Conformidad con el marcado CE y servicios de marcado CE.

- Cumplimiento garantizado de la normativa aplicable reciente.
- Equipo de expertos clínicos cualificados.
- Aportaciones interfuncionales de Dispositivos Médicos para cumplir con los requisitos.
- Servicio completo de cumplimiento, revisión y planificación.





