Resumen Dispositivos Médicos en el Reino Unido
Tras el Brexit, el Reino Unido sigue modificando y ampliando su normativa sobre productos sanitarios. La normativa que debe seguirse en el país se divide geográficamente entre Gran Bretaña (GB) e Irlanda del Norte (NI).La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA)es la autoridad reguladora que se encarga de Dispositivos Médicos. Irlanda del Norte debe cumplir conel Reglamento de la Unión Europea sobre productos sanitarios (EU MDR) 2017/745yel Reglamento sobre productos sanitarios para diagnóstico in vitro (IVDR) 2017/746. Los fabricantes no británicos deben designar a una persona responsable en el Reino Unido (UK RP) para que les ayude a cumplir con estas normativas y garantizar el éxito del proceso Dispositivos Médicos en el Reino Unido.
Autoridad reguladora: Agencia Reguladora de Medicamentos y Productos SanitariosMHRA)
Reglamento: Reglamento sobre productos sanitarios (MDR) 2002*.
Vía reglamentaria: Marcado CE seguido de Notificación
Representante autorizado: Persona responsable británica (RP británica) para fabricantes no británicos
Requisito del SGC: ISO 13485:2016
Evaluación de los datos técnicos: Organismos autorizados del Reino Unido para el marcado UKCA
Marcas válidas: GB - UKCA o CE & NI - CE o CE + UKNI
Formato de presentación: Papel
Formato de presentación: En línea
*La futura normativa sobre productos sanitarios se aplicará a partir del 1 de julio de 2025
Dispositivos Médicos del Reino Unido
Dispositivos Médicos del Reino Unido se basan en el MDR 2002 del Reino Unido. La clasificación del dispositivo es el primer paso de todo el proceso para obtener la aprobación y lanzarlo al mercado.
Dispositivos Médicos
| Clase | Riesgo |
|---|---|
| Clase I | Bajo |
| Clase IIa | Medio |
| Clase IIb | Medio |
| Clase III | Alta |
Clasificación IVD
- DIV general
- Autodiagnóstico de IVD
- DIV incluidos en la lista A del anexo II
- DIV incluidos en la lista B del anexo II
Nuestra empresa está especializada en Dispositivos Médicos . Freyr ha completado con éxito la clasificación de dispositivos para más de 50 empresas hasta la fecha en el Reino Unido.
Servicios de la Persona Responsable del Reino Unido (UKRP)
A partir de ahora, los fabricantes no británicos deberán designar obligatoriamente al UKRP para comercializar sus productos.
Freyr se ha registrado correctamente y ahora puede actuar como su UKRP. Para obtener más información sobre nuestros servicios UKRP, visite - www.ukrpservices.com
Dispositivos Médicos
A partir de ahora, los fabricantes tendrán que designar un organismo autorizado en el Reino Unido para obtener el marcado UKCA. Aunque el marcado CE está permitido, sólo es aplicable durante un determinado periodo de tiempo. Los plazos de transición para el mismo se mencionan a continuación -
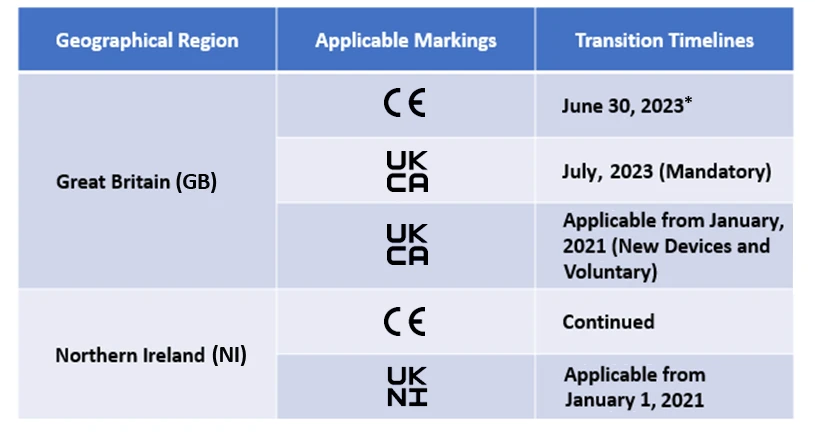
Freyr apoya actualmente a muchos fabricantes en las transiciones posteriores al brexit.
* MHRA del Reino Unido reconoce el actual calendario de transición para el marcado CE con arreglo a EU MDR IVDR y los plazos variarán en función del ámbito de aplicación de los productos.
Requisitos de vigilancia posterior a la comercialización
Los requisitos de vigilancia posterior a la comercialización en virtud del MDR 2002 del Reino Unido son bastante estrictos para garantizar la seguridad y la eficacia para el paciente/usuario. Actualmente, las actividades del PMS incluyen la notificación de incidentes y hallazgos a la MHRA. La MHRA ha publicado una guía exhaustiva al respecto.
Dispositivos Médicos en el Reino Unido
Experiencia Freyr
- Dispositivos Médicos del Reino Unido
- Apoyo a la transición reglamentaria tras el Brexit
- Apoyo normativo para la notificación de MHRA del Reino Unido
- Persona responsable del Reino Unido (UKRP)
- Enlace y apoyo de la Agencia Sanitaria y el Organismo Autorizado