Descripción general del registro de software como Dispositivos Médicos SaMD)
El software como Dispositivos Médicos SaMD), también denominado Dispositivos Médicos (MDSW), es el tema de mayor actualidad en el sector sanitario.Se estimaque SaMD mundial SaMD alcanzará un valor de US 500 millones US en 2027, con una tasa compuesta de crecimiento anual del 21,9 % entre 2020 y 2027. Este crecimiento se debe a diversos factores relacionados con SaMD , como la adopción del Internet de las cosas (IoT), las plataformas sanitarias digitales y la adopción de software para la monitorización continua de parámetros fisiológicos por parte de los proveedores de asistencia sanitaria para la asistencia remota. Esto se ha acelerado aún más debido a la pandemia de COVID, que ha hecho necesarios los servicios de asistencia sanitaria a distancia y, a su vez, ha creado la necesidad de un proceso simplificado de registro de Software as a Dispositivos Médicos SaMD). Existen tres tipos de software relacionados con los dispositivos médicos basados en la clasificación de Software as a Dispositivos Médicos SaMD), tales como:
- Software en Dispositivos Médicos SiMD)
- Software como dispositivos médicosSaMD)
- Software utilizado en la fabricación/mantenimiento de Dispositivos Médicos
Escenario normativo mundial
En lo que respecta a los SaMD, se están utilizando varios tipos para diversas aplicaciones, como cribado y diagnóstico, monitorización y alerta, gestión de enfermedades, etc. Las agencias sanitarias de países desarrollados o altamente regulados, como la UE, US, Canadá y Australia, han definido normativas en torno a los SaMD y algunas de ellas ya han elaborado documentos de orientación, mientras que otras están en proceso de hacerlo. Algunos mercados semirregulados y no regulados consideran este tipo de software como dispositivos médicos, pero no cuentan con directrices diferenciadas y específicas para la clasificación de los Software as Dispositivos Médicos SaMD). Siguen las directrices armonizadas aceptadas internacionalmente para la evaluación y aprobación del software. A continuación se enumeran algunas de las directrices más destacadas disponibles sobre los SaMD:
- Orientación del IMDRF para la clasificación, el SGC, la evaluación de la ciberseguridad y la evaluación clínica
- EU MDR contiene información detallada sobre esta categoría de dispositivos
- Orientaciones del MDCG sobre la cualificación y clasificación de SaMD, requisitos CER / PER para SaMD
- FDA US sobre ciberseguridad, evaluación clínica y requisitos de registro para diferentes tipos de software, como sistemas de decisión, PACS, aplicaciones móviles, etc.
- Documento orientativo de Health Canada sobre definición y clasificación
- Nueva normativa de la TGA sobre productos sanitarios basados en software, que entrará en vigor en agosto de 2020.
El registro de SaMD en otros mercados mundiales se gestionará caso por caso y requiere una estrecha interacción con la agencia sanitaria respectiva para su aprobación. La vía general seguida para el registro de SaMD incluye:
- Determinar si un determinado programa informático es un SaMD
- Clasificación de los dispositivos en función del riesgo
- Identificar las normas aplicables y los datos requeridos por la Agencia Sanitaria correspondiente.
- Generar los datos requeridos por la Agencia correspondiente
- Compilación del expediente técnico según los requisitos del país
- Presentación y resolución de consultas hasta su aprobación
- Gestión del ciclo de vida posterior a la homologación
Asistencia End-to-End Freyren materia End-to-End para SaMD
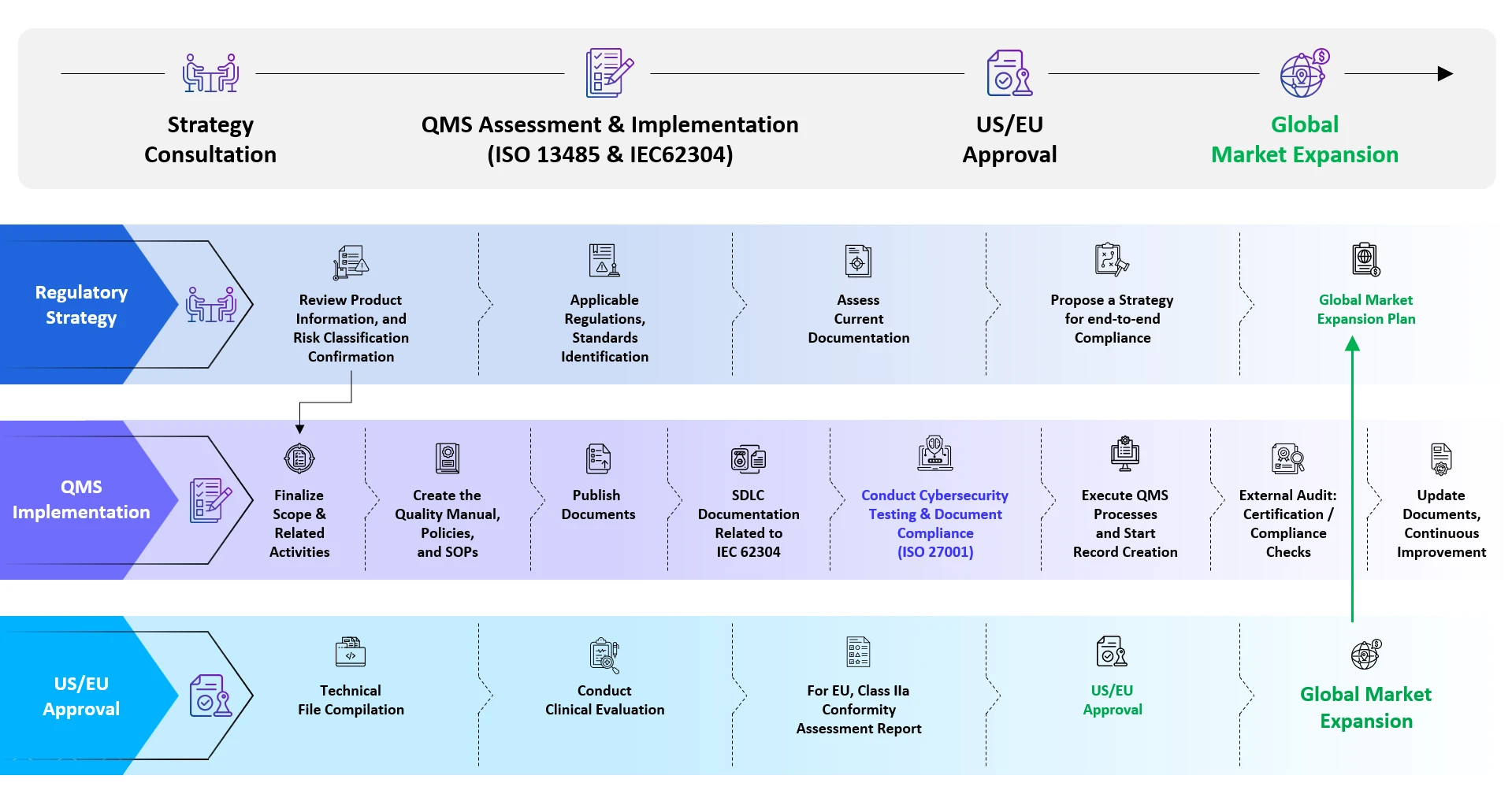
Servicios de registro de software como Dispositivos Médicos SaMD)
Registro de software como Dispositivos Médicos SaMD): experiencia
- Regulatory Intelligence Services
- Diligencia debida reglamentaria / Informes estratégicos
- Calificación y clasificación de SaMD
- Identificación de las normas aplicables
- Análisis de los documentos fuente
- Registro SaMD
- Cumplimiento del Quality Management System (QMS) )
- Servicios de consulta para la evaluación de la ciberseguridad
- Servicios de consulta sobre estudios de evaluación clínica
- Recopilación de informes de evaluación clínica (CER) / informes de evaluación de productos (PER), etc.
- Gestión de cambios posterior a la aprobación





