Visión general de los servicios de conformidad con el IVDR de la UE
El Reglamento Europeo de Diagnóstico In Vitro (RIDIV UE) es una nueva base reglamentaria para la comercialización de productos sanitarios de diagnóstico in vitro en el mercado europeo. El Reglamento sustituirá a la Directiva 98/79/CE sobre productos sanitarios para diagnóstico in vitro. Como reglamento europeo, entrará en vigor en todos los Member States de la UE y en los Estados de la Asociación Europea de Libre Comercio (AELC) sin necesidad de ser incorporado a la legislación de los respectivos Estados. Como socio acreditado en materia de reglamentación, Freyr ofrece servicios de conformidad con el IVDR de la UE y servicios de consultoría sobre el IVDR a los fabricantes para el cumplimiento de la reglamentación sobre diagnóstico in vitro y el marcado CE.
Concierte una reunión con nuestros expertos en IVDR de la UE
El Reglamento IVDR - Calendario de transición
El nuevo IVDR de la UE, que entrará en vigor el 26 de mayo de 2022, se considera un cambio significativo en la supervisión reglamentaria de los DIV. A continuación se ofrece una visión general de la transición al IVDR.
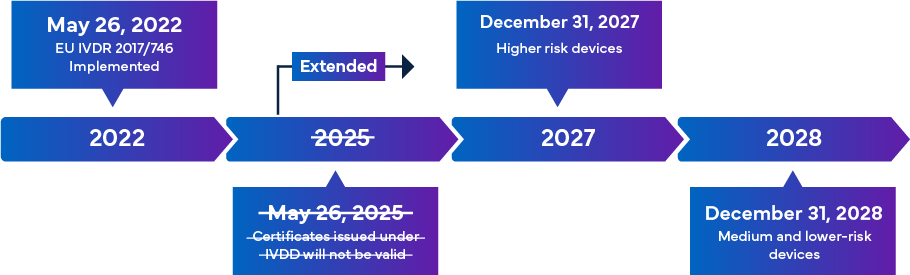
Una vez implementadas en su totalidad, las normas de cumplimiento del IVDR garantizan que casi todos los IVD que entren en el mercado europeo estén sujetos a la revisión del Organismo Notificado (ON) del IVDR y a la certificación del marcado CE como parte del Proceso de Aprobación del IVD. En este escenario, además de alinearse con la clasificación actualizada del IVDR, existe un requisito inmediato para que los fabricantes revisen eficazmente la documentación técnica clave para el éxito del registro del IVD y el marcado CE. Los requisitos del IVDR varían según la clase de riesgo del DIV. En general, para la Certificación IVD, los fabricantes deben realizar:
- Revisiones técnicas de expedientes según el reglamento IVDR (Reglamento UE 2017/746)
- Preparación del Informe de Evaluación del Rendimiento (PER) de todos los DIV
- Seguimiento del funcionamiento poscomercialización (PMPF) según el anexo XIII, parte B, del IVDR.
- Informes de vigilancia de conformidad con el artículo 82 del IVDR
Freyr ayuda a los clientes a realizar una revisión sistemática de la literatura científica y les presta asistencia en la planificación y preparación de un PER para el cumplimiento de la normativa sobre productos sanitarios para diagnóstico in vitro. Freyr cuenta con expertos dedicados que prestan servicios de consultoría sobre el IVDR y Post-market Surveillance (PMS) , que forma parte integrante del sistema de gestión de la calidad del fabricante junto con el seguimiento del rendimiento poscomercialización (PMPF).
Obtenga asesoramiento experto sobre el cumplimiento del Reglamento sobre DIV de la UE
Experiencia y ventajas de los servicios de conformidad con el IVDR de la UE
- Plan de transición para el cumplimiento del IVDR
- Revisión técnica y análisis de las deficiencias de los requisitos del IVDR para los requisitos generales de seguridad y prestaciones (GSPR)
- Apoyar la compilación del expediente técnico conforme a los requisitos del IVDR.
- Informes de validez científica basados en la bibliografía y/o en datos internos
- Informes de rendimiento clínico basados en bibliografía y/o datos internos
- Pruebas clínicas o informes de evaluación del rendimiento
- Protocolos e informes de seguimiento del rendimiento poscomercialización (PMPF)
- Post-market Surveillance (PMS) e informes de Post-market Surveillance (PMS)
- Redacción/revisión de otros documentos, como prospectos/IFU (instrucciones de uso), instrucciones de referencia rápida (QRI), manual de funcionamiento/usuario, etc.

- Cumplimiento garantizado del IVDR, registro IVD y marcado CE
- Sólidos conocimientos y experiencia en materia de reglamentación en las principales áreas de impacto de los IVDR de la UE.
- Sólido modelo de entrega impulsado por la gestión de proyectos para garantizar el cumplimiento del calendario
- Expertos internos de NB (revisión del informe por los revisores interactivos de NB)
- Equipos especializados en áreas de impacto específicas y categorías de dispositivos.
- Aportaciones multifuncionales de Dispositivos Médicos para cumplir con los requisitos.
- Servicio completo de conformidad, revisión y planificación
- Gran experiencia en el mantenimiento de la coherencia de los entregables (plazo y calidad).





