Servicios de etiquetado clínico - Descripción general
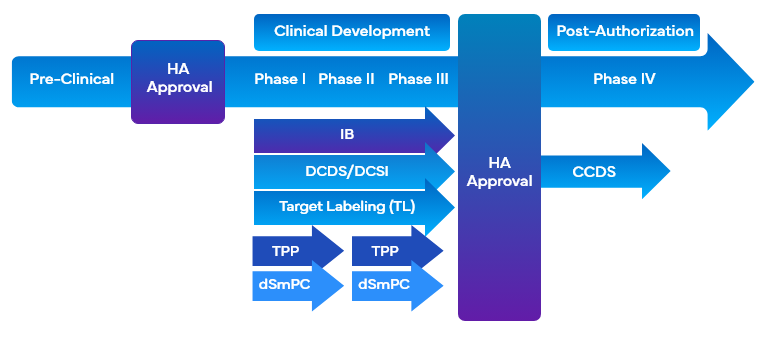
Durante el desarrollo de fármacos, las empresas utilizan diversas herramientas relacionadas con el etiquetado clínico que emplean el etiquetado objetivo para facilitar el desarrollo de fármacos. Estas herramientas alinean simultáneamente los objetivos deseados de comercialización y etiquetado de los ensayos clínicos con el diseño del programa de desarrollo o el diseño del estudio y facilitan la redacción de la descripción clínicaCO). Algunas de las herramientas de etiquetado clínico que utilizan el etiquetado objetivo durante el desarrollo de fármacos son:
- Folleto del investigadorIB)
- Etiquetado de objetivosTL)/Perfil de objetivos
- Hoja de datos del núcleo de desarrolloDCDS)
- Desarrollo de información básica sobre seguridadDCSI)
- Perfil de producto objetivoTPP) FDA
Es importante que las empresas empleen un enfoque modular al recopilar la información sobre seguridad y eficacia en varios tipos de etiquetas clínicas para complementar los requisitos del etiquetado clínico. Esto satisfaría la necesidad de ayudar eficazmente a los investigadores y patrocinadores mediante la presentación y actualización de una sección DCSI centrada y dedicada que puede colocarse convenientemente bajo diferentes categorías clínicas.
Además, DCSI se incluye en la Información básica de seguridad de la empresaCCSI), que es la base de la primera Hoja de datos básicos de la empresaCCDS) y se utiliza para la entrada del producto en el mercado. También es necesario redactar un CO exhaustivo que incluya el alcance y las cuestiones críticas del programa de desarrollo clínico sobre el fármaco para respaldar la documentación destinada a los evaluadores.
Servicios de etiquetado clínico de Freyr
Servicios de etiquetado clínico
- Creación y revisión del folleto de investigación (IB)
Freyr tiene una experiencia considerable en la creación, autoría y revisión de IB para diversos programas en fase clínica de nuestros clientes. Los MI son las formas más incipientes de etiquetas destinadas a proporcionar al investigador o al médico tratante información relevante sobre el fármaco o la intervención. Su objetivo es proporcionar a los investigadores y demás personas implicadas en el ensayo la información necesaria para facilitarles la comprensión de la justificación y el cumplimiento de muchas características clave del protocolo. Entre ellas se incluyen la dosis, la frecuencia/intervalo de la dosis, los métodos de administración y los procedimientos de control de la seguridad. El IB contiene información preclínica y clínica relacionada con un medicamento en investigación.

Al trabajar en los IB, los expertos en etiquetado clínico de Freyrpresentan la información de forma concisa, sencilla, objetiva y equilibrada. Estas mismas cualidades también pueden tenerse en cuenta a la hora de traducir los documentos. Además de la autoría de los MI, Freyr también apoya la revisión anual de los MI y trabaja en las revisiones necesarias, de conformidad con los procedimientos estándar establecidos por los clientes y patrocinadores.
- Desarrollo del etiquetado de objetivosTL)/perfil de objetivos
- Desarrollo y revisión de DCDS y DCSI
Freyr ha demostrado su experiencia en la creación de Fichas de Datos Fundamentales para el Desarrollo (DCDS) de alta calidad. La DCDS es una etiqueta intermedia fundamental para derivar el contenido de las etiquetas nacionales first-to-file (como USPI, SmPC, etc.). La DCSI se prepara a partir de la etiqueta de destino, y proporciona seguridad y eficacia integradas a una intervención o medicamento. El DCSI ayuda a los investigadores y patrocinadores presentando y actualizando secciones DCDS específicas y dedicadas que pueden colocarse convenientemente dentro del IB. La DCSI facilita el desarrollo de CCSI, que posteriormente forma parte integrante de la Ficha de Datos Fundamentales de la SociedadCCDS).
- Desarrollo y revisión del perfil de producto objetivoTPP) FDA y del proyecto de SmPC de la UE (dSmPC)
El perfil del producto objetivo (TPP) y el resumen preliminar de las características del producto (dSmPC) son una forma de etiqueta clínica que facilita las conversaciones entre las empresas farmacéuticas y las autoridades sanitarias. El TPP se utiliza a lo largo de todo el proceso de desarrollo de un fármaco, desde las fases previas a la solicitud de nuevo fármaco en investigación (IND) y la solicitud de nuevo fármaco en investigación (IND) hasta los programas posteriores a la comercialización, con el fin de buscar nuevas indicaciones u otros cambios sustanciales en el etiquetado de los ensayos clínicos. Las empresas farmacéuticas especifican los conceptos de etiquetado que son los objetivos del programa de desarrollo de fármacos en forma de TPP. TPP proporciona una declaración de la intención general del programa de desarrollo de fármacos y ofrece información sobre el fármaco en una fase concreta del desarrollo. Como socio estratégico en materia de regulación, Freyr tiene experiencia en la preparación de TPP para EE US dSmPc para la UE.
- Recursos con profundos conocimientos normativos sobre envasado y etiquetado clínico
- Experiencia en la gestión con éxito del etiquetado global y regional de medicamentos para clientes farmacéuticos de Fortune en EE.UU., EUROPA, APAC, MENA, etc.
- Experiencia en reglamentación mundial para ayudar a organizaciones de ciencias de la vida, como farmacéuticas, biotecnológicas y fabricantes de productos nutricionales.
- Redactores médicos altamente cualificados con amplia experiencia en etiquetado reglamentario
- Conocimiento profundo y actualizado de los cambios globales en el etiquetado de medicamentos por parte de múltiples autoridades sanitarias como USFDA, EMA, la TGA, etc.
- Un equipo dedicado al cumplimiento de la normativa que realiza el seguimiento del estado de implantación de las fichas de datos básicos y de empresaCDSCCDS) en las etiquetas regionales.
- Experiencia en etiquetado de ensayos clínicos y servicios de etiquetado clínico
- Profesionales con gran experiencia en etiquetado farmacéutico, biotecnológico y nutricional





