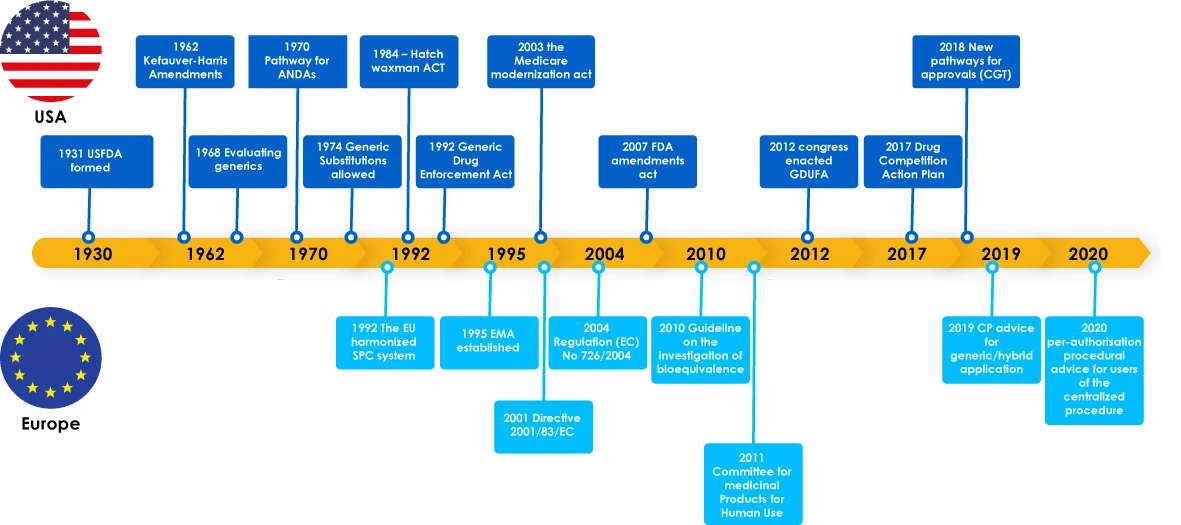
Evolución de los genéricos
Los medicamentos genéricos marcaron hitos importantes, como las leyes reguladoras de apoyo al desarrollo de genéricos, que animaron a los fabricantes a explorar el mercado de genéricos. Estas leyes también dieron confianza a los médicos para recetar un sustituto de un medicamento de marca, lo que acabó beneficiando a los pacientes, ya que los fabricantes de genéricos satisfacían necesidades críticas de pacientes de todo el mundo.
Preguntas frecuentes sobre genéricos
P1: ¿Qué son los medicamentos genéricos?
Respuesta: Los medicamentos genéricos son copias idénticas del medicamento original y tienen el mismo principio activo, dosis, uso previsto, efectos secundarios, vía de administración, riesgos, seguridad y potencia que el medicamento innovador, pero pueden diferir en algunas características como el proceso de fabricación, la formulación, los excipientes, el color, el sabor y el envase. En otras palabras, un medicamento genérico es terapéuticamente equivalente a un medicamento de marca y, por lo tanto, puede ser sustituido por su homólogo de marca.
P2: ¿Por qué los medicamentos genéricos cuestan menos que los innovadores?
Respuesta: Los medicamentos genéricos son más rentables que los innovadores porque no tienen que repetir los largos y costosos estudios preclínicos y clínicos que se exigen a los medicamentos innovadores para demostrar su seguridad y eficacia, sino que sólo tienen que demostrar la equivalencia farmacéutica de su producto.
P3: ¿Son los medicamentos genéricos tan buenos como los innovadores?
Respuesta: Sí, los medicamentos genéricos tienen la misma calidad, eficacia y seguridad que los de marca. El precio más bajo de estos medicamentos no indica que sean de calidad inferior, porque los medicamentos genéricos, al igual que los de marca, tienen que someterse a un riguroso proceso de aprobación para comercializar su producto y las empresas farmacéuticas tienen que presentar una solicitud de medicamento genérico que demuestre que su producto tiene los mismos beneficios clínicos que los medicamentos de marca y que puede utilizarse como sustituto de su respectivo medicamento de marca.
P4: ¿Por qué los medicamentos genéricos son diferentes de los de marca?
Respuesta: Los medicamentos genéricos deben ser bioequivalentes a los medicamentos de marca y tener el mismo API que los medicamentos innovadores. Sin embargo, puede haber diferencias mínimas en los medicamentos genéricos en cuanto a la forma, el etiquetado (diferencias menores), el envasado y los ingredientes inactivos como el color, los aromas y los conservantes, pero la eficacia del medicamento debe seguir siendo la misma.
P5: ¿En qué consiste el proceso de revisión y aprobación de las solicitudes de medicamentos genéricos en los US?
Respuesta: Cualquier empresa farmacéutica que comercialice sus medicamentos genéricos en los US cumplir con todos los requisitos reglamentariosFDA US para la presentación de medicamentos genéricos y debe demostrar que:
- El medicamento genérico es "farmacéutica/terapéuticamente equivalente" al de marca
- El fabricante es capaz de fabricar el medicamento de forma correcta y constante
- El "principio activo" es el mismo que el de la marca
- La cantidad correcta del principio activo llega al lugar del cuerpo donde tiene efecto.
- Los ingredientes "inactivos" del medicamento son seguros
- El fármaco no se descompone con el tiempo
- El envase en el que se enviará y venderá el medicamento es adecuado
- La etiqueta es la misma que la del medicamento de marca
- Las patentes o exclusividades legales pertinentes han expirado
P6: ¿Tiene cada medicamento de marca un genérico?
Respuesta: No. Cada medicamento de marca no tiene una versión genérica. Los nuevos medicamentos se fabrican bajo protección de patente durante un máximo de veinte (20) años. Esto significa que no se puede fabricar ni comercializar ningún otro medicamento durante este periodo, hasta la expiración de la patente. Sin embargo, es posible que algunos medicamentos nunca tengan versiones genéricas para su producto, debido a la dificultad de fabricación o en caso de que el medicamento genérico no resulte rentable.




