ResumenDispositivos Médicos enFDA US
Estados Unidos (EE. UU.) es conocido por ser un mercado altamente regulado en lo que respecta a los dispositivos médicos, con vías y requisitos de registro bien definidos. Dispositivos Médicos primeras Dispositivos Médicos de EE. UU. se remontan a 1976 y han evolucionado con el tiempo. Están reguladas por el Centro de Dispositivos y Salud Radiológica (CDRH) dependiente de la Administración de Alimentos y Medicamentos (FDA). Freyr ha ayudado a múltiples fabricantes de dispositivos a cumplir con el procesoDispositivos Médicos FDA US

Autoridad reguladora: Administración de Alimentos y MedicamentosFDA)
Reglamento: Título 21 del Código de Reglamentos Federales (21 CFR) Partes 800 - 1299
Vía reglamentaria: Notificación previa a la comercialización o Aprobación previa a la comercialización o Clasificación De-Novo
Representante autorizado: Agente de EE.UU.
Requisito del SGC: Reglamento sobre sistemas de calidad (QSR) (21 CFR, parte 820)
Evaluación de los datos técnicos: Centro de Dispositivos y Salud Radiológica
Validez de la licencia: Sin límites
Requisitos de etiquetado: 21 CFR Parte 801
Formato de presentación: Papel y CD/DVD
Idioma: Inglés
Dispositivos Médicos en EE. UU.
FDA clasifica los productos sanitarios en tres categorías basadas en el riesgo: Clase I, Clase II y Clase III. Los productos de Clase I se consideran de bajo riesgo, mientras que los de Clase III se consideran de alto riesgo. Los requisitos y la vía de registro varían en función de la clase de producto.
| Clase de dispositivo | Riesgo | Vía de registro para su aprobación |
|---|---|---|
| I | Riesgo bajo | Exento de 510(k) |
| II | Riesgo moderado (Con dispositivo predicado) | Notificación previa a la comercialización/510(k) |
Riesgo moderado (sin predicado) | Aplicación De-Novo | |
| III | Alto riesgo | Aprobación previa a la comercialización (PMA) |
Agente de FDA EE.UU.
Las empresas que no tengan oficinas locales en los Estados Unidos deben designar a un FDA estadounidensepara que represente al fabricante. El FDA estadounidense debe residir en los Estados Unidos o tener un lugar de trabajo en los Estados Unidos. Las responsabilidades que debe cumplir el agente están predeterminadas por laFDA US FDA parte de las regulaciones del CFR.
Navegapor las preguntas frecuentes (FAQ) sobre US .
Reuniones interactivas con laFDA US
FDA US FDA los fabricantes a través de diversos tipos de reunionesde presentación de calidad (Q-Submission)para cumplir diferentes objetivos. Estas reuniones con la agencia antes del inicio o durante el desarrollo del dispositivo, antes de la presentación de las solicitudesDispositivos Médicos FDA US , ayudan a los fabricantes a optimizar los plazos y los costes derivados de la comercialización del dispositivo.
Dispositivos Médicos en EE. UU.
Los dispositivos pueden ser aprobados por el CDRH, la FDA a través de cualquiera de las diversas vías de registro. Se enumeran como:
Dispositivos médicos de clase I:Los dispositivos de clase I suelen estar exentos de la presentación de GMP y 510(k) y no requieren la aprobación previa de laFDA US FDA comercializarlos en ese país. El fabricante debe cumplir otros requisitos, como el registro del establecimiento, la inclusión del dispositivo en la lista, el UDI, el PMS, etc.
Dispositivos médicos de clase II:los dispositivos de riesgo medio con dispositivos predicados aprobados por 510(k) pueden optar por la notificación previa a la comercialización (PMN) 510(k), también denominadaregistro 510(k). El dispositivo en cuestión deberá establecer una equivalencia sustancial (SE) con los dispositivos predecesores identificados y reivindicados. Esta vía es la más utilizada para el registro de dispositivos en los Estados Unidos. Los fabricantes de dispositivos de riesgo medio sin predecesores pueden solicitar la clasificación por parte de laFDA US FDA solicitudes De-Novo.
Dispositivos médicos de clase III:Los fabricantes de dispositivos de clase III de alto riesgo deben presentar una solicitud de autorización previa a la comercialización (PMA) a laFDAUS Los dispositivos deben someterse a una evaluación clínica detallada y el fabricante debe presentar datos detallados sobre la seguridad y la eficacia obtenidos en estudios clínicos. LaFDA US FDA a cabo una inspección del sistema de gestión de la calidad como parte de la evaluación antes de emitir unaautorización previa a la comercializaciónpara el dispositivo.
Dispositivos Médicos no CDRH
Basándose en las indicaciones de uso, algunos productos fronterizos considerados productos sanitarios en otros países, como los respiradores quirúrgicos, los desinfectantes y los productos combinados, implican a otras agencias, como el Centro de Control de Enfermedades (CDC), el Instituto Nacional de Seguridad y Riesgos Laborales (NIOSH), la Agencia de Protección del Medio AmbienteEPA, el Centro de Evaluación e Investigación Biológica (CBER) y el Centro de Evaluación e Investigación de Medicamentos (CDER).
Requisitos de conformidad posteriores a la aprobación para productos sanitarios
Todos los fabricantes de dispositivos deben cumplir los siguientes requisitos posteriores a la homologación:
- Requisitos de registro y cotización: Los establecimientos de todas las clases de productos deben estar registrados en la base de datos FURL y el producto debe figurar en la lista una vez obtenida la aprobación y antes de la comercialización del producto en los EE.UU. Algunos productos, como los dispositivos de radiación, deben cumplir otros requisitos, como el número de acceso, antes de poder ser importados en los EE.UU.
- Identificación única de dispositivos: Todas las clases de dispositivos deben cumplir la normativa de identificación única de dispositivos (UDI ) para comercializarlos en EE.UU.
- Tarifas de establecimiento: El fabricante debe pagar las tasas anuales de establecimiento para mantener activa su inscripción como establecimiento y poder seguir comercializando dispositivos en los Estados Unidos. LaFDA US FDA reducido la estructura de tasas para las entidades más pequeñas que cuenten con un certificado de pequeña empresa activo.
- Auditorías de calidad: Paralos dispositivos que no están exentos de las buenas prácticas de fabricación (GMP), la FDA US FDA inspeccionar el establecimiento de fabricación en cualquier momento para verificar el cumplimiento de las Normas de Sistemas de Calidad (QSR) de acuerdo con el 21 CFR 820.
Flujo del proceso
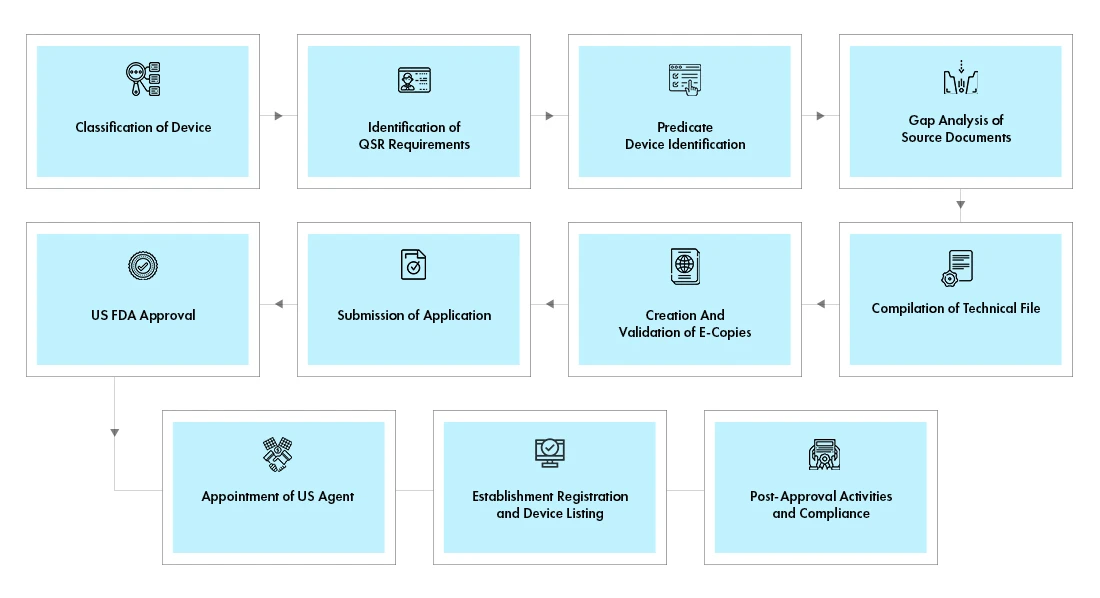
Gestión del ciclo de vida de los dispositivos tras su aprobación
Freyr presta apoyo a fabricantes extranjeros en la gestión end-to-end Dispositivos Médicos , incluidas las actividades posteriores a la aprobación, tales como:
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes o accesorios, la incorporación de nuevas indicaciones de uso, entre otras.
- Mantenimiento de las autorizaciones y el registro mediante el pago puntual de las tasas MDUFA a FDA.
- Enlace entre laFDA US FDA el fabricante
Freyr dispone de un centro de entrega exclusivo en los EE.UU. con un equipo profesional para proporcionar apoyo reglamentario a los fabricantes en el mantenimiento de la calidad y la seguridad necesarias para la aprobación. Los expertos en inteligencia de Freyrobservan atentamente las actualizaciones normativas y mantienen informados a los clientes sobre los pasos que deben dar para que el producto cumpla la normativa vigente.
Resumen
| Riesgo | Clase de dispositivo | Auditoría del SGC | Disponibilidad de predicados | Vía reglamentaria | Agente de EE.UU. | US FDA |
|---|---|---|---|---|---|---|
| Riesgo bajo | I | No | NA | Exento | Sí | 1 mes |
| Riesgo medio | II | Sí (post aprobación) | Sí | PMN/510(k) | Sí | 9 - 12 meses |
| Riesgo medio | II | Sí (post aprobación) | No | Solicitud de clasificación de-novo | Sí | 18 - 30 meses |
| Alto riesgo | III | Sí (aprobación previa) | NA | PMA | Sí | 18 - 30 meses |
Servicios de registro Dispositivos Médicos de Freyr
Experiencia Freyr
- Diligencia debida reglamentaria
- Documentación de Dispositivos Médicos
- 513(g) ayuda
- Registro 510(k)
- Solicitud de clasificación de-novo
- Registro PMA
- 21 CFR 820 conformidad
- Apoyo a la auditoría BIMO
- MDSAP Conformidad
- Soporte de etiquetado
- Apoyo a la publicación y presentación
- Agente de EE.UU.
- Reuniones de presentación de Q
- Reuniones RFD y Pre-RFD
- Certificación de pequeñas empresas
- Registro de establecimientos y lista de dispositivos
- Cumplimiento de la normativa sobre productos sanitarios radiactivos
- Gestión de cambios tras la aprobación
- Post Market Surveillance
- Cumplimiento de UDI
- Asesoramiento normativo para subsanar deficiencias