
Las auditorías de buenas prácticas de fabricación (BPF) y buenas prácticas de distribución (GDP) son fundamentales para garantizar la calidad, la seguridad y la integridad de los productos farmacéuticos a lo largo de su ciclo de vida. Llevar a cabo investigaciones exhaustivas durante estas auditorías es esencial para identificar y rectificar cualquier desviación, incumplimiento o riesgo potencial. En esta entrada del blog, exploraremos la importancia de las investigaciones en profundidad duranteGDP y proporcionaremos información valiosa sobre cómo llevar a cabo investigaciones eficaces para el cumplimiento normativo.
Comprender la importancia de las investigaciones en profundidad
- Identificar las causas profundas: Las investigaciones en profundidad ayudan a descubrir las causas subyacentes de las desviaciones o los problemas de incumplimiento, lo que permite a las empresas abordar las causas profundas en lugar de limitarse a tratar los síntomas.
- Prevenir la recurrencia: Al comprender las causas profundas, las empresas pueden aplicar acciones correctivas y preventivas (CAPA) para evitar que se repitan problemas similares en el futuro, mejorando así el cumplimiento general y la calidad del producto.
- Garantizar la seguridad del producto: Las investigaciones exhaustivas garantizan que cualquier riesgo potencial para la seguridad o la eficacia del producto se identifique y mitigue rápidamente, salvaguardando la salud y el bienestar del paciente.
- Mantener el cumplimiento normativo: Las autoridades reguladoras esperan que las empresas lleven a cabo investigaciones exhaustivas sobreGDP ) y las buenas prácticas deGDP y adopten las medidas correctivas adecuadas para mantener el cumplimiento de las normas reglamentarias.
Pasos clave en la realización de investigaciones en profundidad:
- Revisión de documentos: Comience por revisar la documentación pertinente, incluidos standard operating procedures (SOPs), los registros de lotes, los informes de desviaciones y los resultados de auditorías anteriores, para obtener información sobre el problema en cuestión.
- Análisis de la causa raíz: Utilizar herramientas y metodologías como los 5 porqués, los diagramas de espina de pescado (Ishikawa) o el análisis modal de fallos y efectos (AMFE) para identificar sistemáticamente las causas raíz de las desviaciones o los problemas de incumplimiento.
Diagrama de espina de pescado como ejemplo
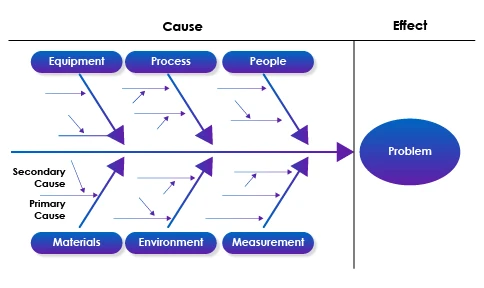
- Recogida de datos: Recopilar datos y pruebas pertinentes mediante entrevistas, observaciones y análisis de datos para respaldar los resultados y conclusiones de la investigación.
- Colaboración interfuncional: Involucrar a equipos interfuncionales, incluyendo los de control de calidad, fabricación, cadena de suministro y Asuntos Regulatorios, en el proceso de investigación para garantizar una comprensión integral del problema y facilitar la resolución eficaz del mismo.
- Acciones correctivas y preventivas (CAPA): Desarrollar y aplicar CAPAs basadas en los resultados de la investigación para abordar las causas de raíz y prevenir la repetición de problemas similares en el futuro.
- Mejora continua: Utilice los conocimientos obtenidos de las investigaciones para impulsar iniciativas de mejora continua, como la optimización de procesos, los programas de formación o las actualizaciones tecnológicas, con el fin de mejorar la calidad y el cumplimiento generales.
Conclusión:
Llevar a cabo investigaciones exhaustivas duranteGDP es esencial para mantener el cumplimiento normativo, garantizar la calidad de los productos y proteger la seguridad de los pacientes. Siguiendo procesos de investigación sistemáticos, identificando las causas fundamentales y aplicando medidas correctivas y preventivas sólidas, las empresas pueden reforzar sus sistemas de gestión de la calidad y demostrar su compromiso con el cumplimiento normativo y la mejora continua. Las investigaciones eficaces no solo mitigan los riesgos, sino que también contribuyen a crear una cultura de calidad y excelencia dentro de la organización.









