
La publicidad farmacéutica, incluida la publicidad dirigida directamente al consumidor, está regulada por la Oficina de Promoción de Medicamentos Recetados (OPDP) de la Administración de Alimentos y MedicamentosUS FDA), la División de Publicidad y Etiquetado Promocional (APLB) del Centro de Evaluación e Investigación de Medicamentos (CDER) y el Centro de Evaluación e Investigación Biológica (CBER), respectivamente. La información presentada a la OPDP y la APLB ser precisa, ética y no engañosa. Se debe incluir información adicional sobre los beneficios y riesgos del producto en la presentación. Las Oficinas también revisan los materiales promocionales presentados a la Agencia.
En abril de 2022, laFDA US FDA una guía sobre la presentación de material promocional de etiquetado y publicidad. La guía ayuda a comprender la presentación electrónica en el Módulo 1 del eCTD, utilizando la versión 3.3 o superior del archivo US. En el documento se mencionan los tipos de materiales promocionales que no están sujetos a la presentación electrónica obligatoria en virtud del artículo 745A. Se aceptarán copias en papel de todos los tipos de presentaciones promocionales hasta veinticuatro (24) meses después de publication de la guía.
Excepción
El documento establece que las presentaciones en virtud de la sección 505(b), (i) o (j) de la Ley Federal sobre Alimentos, Medicamentos y Cosméticos (FD&C Act) y las presentaciones en virtud de la sección 47 351(a) o (k) de la Ley de Servicios de Salud Pública (PHS Act) deben presentarse en formato electrónico, tal y como lo define la FDA. Este documento no está sujeto a las restricciones habituales de las normas de buenas prácticas FDA, ya que no está establecido legalmente para responsabilidades exigibles. Por lo tanto, la parte de esta guía que establece el requisito de las presentaciones electrónicas en virtud de la sección 745A(a) de la Ley FD&C tiene un efecto vinculante, tal y como indican los términos «debe», «deberá» o «se requiere».
La FDA el material promocional redactado en un plazo de cuarenta y cinco (45) días a partir de la presentación voluntaria por parte de los patrocinadores. Para cualquier consulta relacionada con el producto planteada por los profesionales sanitarios, los consumidores, los patrocinadores de medicamentos o los bufetes de abogados, la OPDP concede a los patrocinadores un plazo de treinta (30) días naturales para responder.
Definición de material promocional
La expresión «material promocional» se refiere al etiquetado promocional y a los materiales publicitarios, independientemente del formato, la forma o el medio a través del cual se comuniquen. La FDA supervisa FDA dos (02) tipos de etiquetado para los medicamentos:
- Etiquetado FDA
- Etiquetado promocional
Según la sección 201(m) FDA, el etiquetado se define como «todas las etiquetas, además de las escritas, impresas o grabadas en relieve en cualquier envase, envoltorio o artículo, o que acompañen a dicho artículo». La expresión «que acompañen a dicho artículo» se considera una interpretación o explicación del material promocional, tal y como ha declarado el Tribunal US .
Criterios de presentación de material promocional para su revisión
- Inclusión de BLA NDA, ANDA o BLA adecuados.
- En los casos en que los solicitantes requieran una revisión inmediata, dirija los envíos al Director del Proyecto OPDP
- En el formulario FDA , asigne el tipo de material más específico para representar el material promocional.
- Los distintos tipos de materiales se presentarán por separado
- No mezcle otros envíos con material promocional
- El material promocional dirigido a los profesionales sanitarios debe presentarse por separado del dirigido a los consumidores.
Las siguientes métricas aclaran el recuento de formularios 2253 presentados y los materiales incluidos en estos envíos.
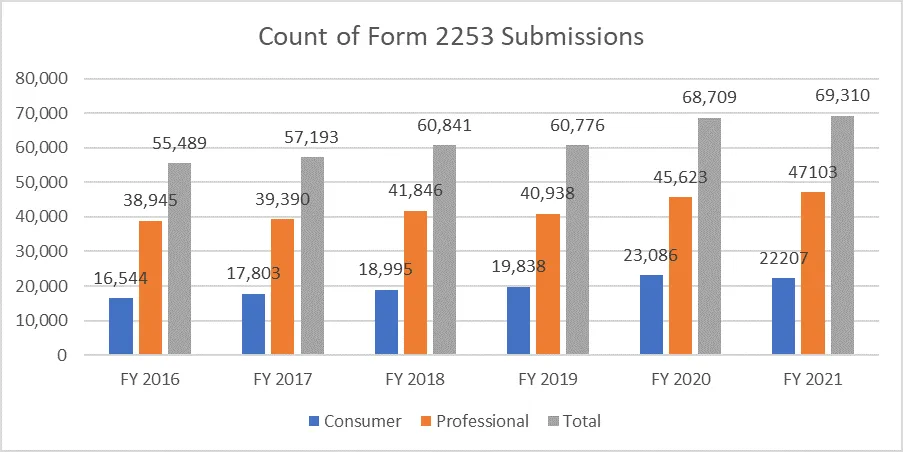
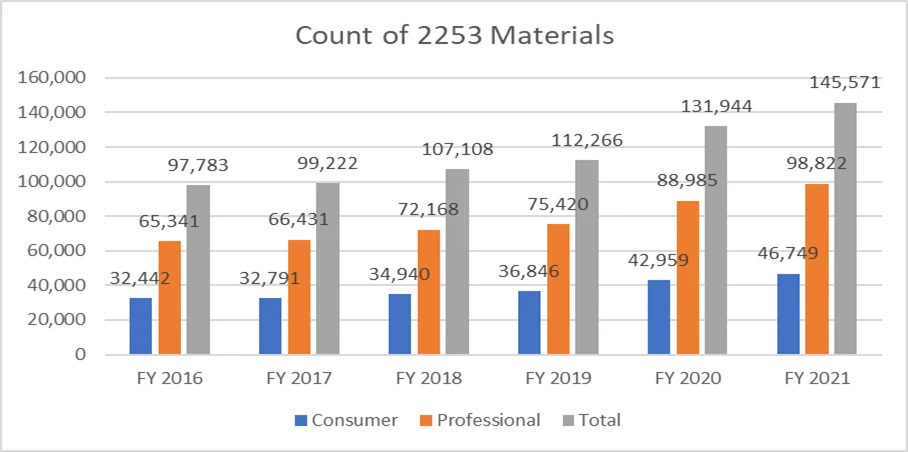
Es de suma importancia que los patrocinadores redacten su material promocional siguiendo las directrices proporcionadas por la FDA evitar múltiples ciclos de revisión, dado el coste del proceso. Contar con recursos que puedan facilitar el proceso de presentación de material promocional sin contratiempos puede permitir a los patrocinadores alcanzar sus objetivos comerciales y mantenerse a la altura de los requisitos reglamentarios. Un socio reglamentario de probada eficacia como Freyr garantizar una revisión completa del material promocional y no promocional antes de su presentación, ya sea en formato electrónico o no electrónico. Póngase en contacto con Freyr hoy mismo para redactar material promocional claro, conciso y conforme a la normativa desde el primer momento.









