Mientras que los medicamentos innovadores o de marca conllevan costes adicionales asociados a la investigación y el desarrollo del producto desde la fase de identificación de la molécula hasta la autorización posterior a la comercialización, los genéricos son relativamente rentables. Estas terapias no sólo reducen el coste global del tratamiento, sino que también mejoran significativamente el acceso de los pacientes a medicamentos que salvan vidas. Dado que la dependencia de la importación de antibióticos genéricos y la terapia farmacológica de enfermedades raras afectó a la disponibilidad de estos medicamentos en todo el mundo en medio de la pandemia, los organismos sanitarios están introduciendo nuevas directrices para apoyar a los fabricantes locales de medicamentos.
Desde 1993, la organización comercial Medicamentos para Europa, antes conocida como Asociación Europea de Medicamentos Genéricos (EGA), ha sido coherente con su objetivo de familiarizar a la población europea de pacientes con terapias rentables. Durante la última década, han suministrado con éxito el 67% de todos los medicamentos a Europa, ampliando el acceso de los pacientes al 100% en siete (07) áreas terapéuticas clave. En el ámbito de las autoridades sanitarias europeas, una "autonomía estratégica" post-Brexit puso en marcha un requisito inmediato para remediar eficazmente la desventaja competitiva a la que se enfrentan los fabricantes europeos de genéricos y biosimilares. Con la llegada de la pandemia de COVID-19, las capacidades de la cadena de suministro mundial sucumbieron bajo la presión de la demanda de medicamentos. Los medicamentos que salvaban vidas y aliviaban enfermedades crónicas desaparecieron de las estanterías de las farmacias locales. Para superar los obstáculos a los medicamentos protegidos por patentes y desarrollar la capacidad local de fabricación de fármacos para mejorar el acceso de los pacientes, el Consejo de la UE adoptó un reglamento que establece una excepción a una molécula original mediante la concesión de un Certificado Complementario de Protección (CCP). La disposición facilita la fabricación de genéricos y biosimilares antes de la expiración de la patente con fines de almacenamiento o exportación. Sin embargo, la excepción sólo será aplicable en las siguientes circunstancias.
- Los genéricos o biosimilares producidos se destinan exclusivamente a la exportación a otro país donde la patente de la molécula del medicamento no existe o ha expirado, o para fines de almacenamiento dentro del plazo de patente pendiente de seis (06) meses.
- De acuerdo con el requisito, el fabricante ha transmitido la información a la Autoridad Sanitaria local y al titular del CCP antes de tres (03) meses.
- El fabricante ha informado a todas las partes interesadas en la comercialización del producto.
- El fabricante se ha asegurado de que los requisitos de etiquetado establecen que el medicamento indica que sólo se destina a la exportación.
De hecho
Desde la concesión de la autorización condicional de comercialización de los productos vacunales COVID-19 en la UE, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos ha autorizado cuatro (04) centros de producción de vacunas en el plazo de un año; dos (02) en Suiza y dos (02) en los Estados Unidos. Estas decisiones a favor de la ampliación de los centros de producción mejorarán las capacidades de fabricación de vacunas, al tiempo que las harán más accesibles a la población europea.
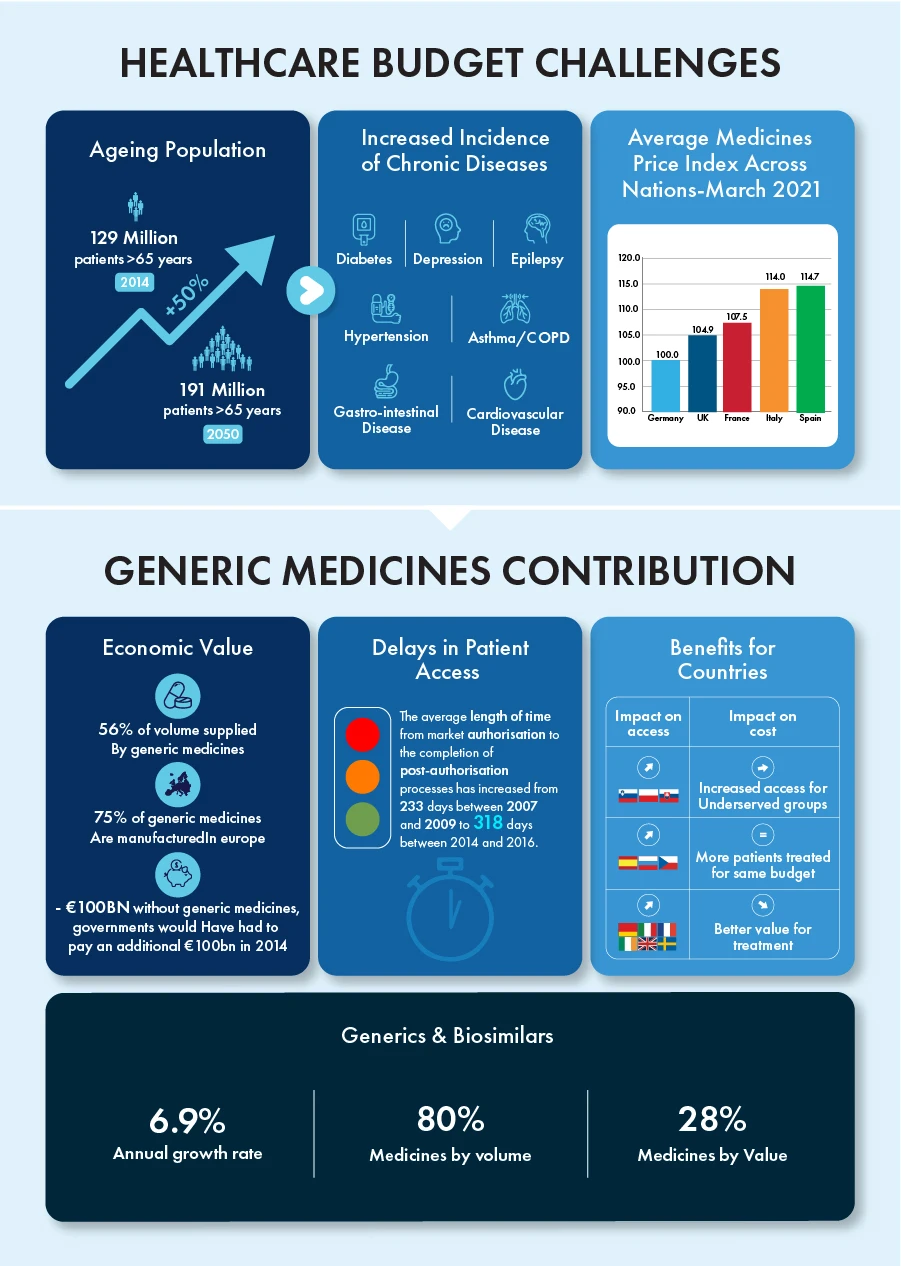
Los genéricos y los biosimilares han contribuido por sí solos a una tasa de crecimiento anual del 6,9%, al tiempo que representan el 80% de todos los medicamentos en volumen y el 28% en valor en la última década. En 2023 finalizará el plazo de patente de determinados productos biológicos valorados en unos 90.000 millones de euros, lo que creará un entorno competitivo para estos productos con un enorme potencial de crecimiento.
La aplicación de una exención del CCP beneficiaría a la Unión Europea en los siguientes aspectos:
- Añadiendo aproximadamente 90.500 millones de euros adicionales al año.
- Creación de veinticinco mil (25 000) nuevas oportunidades de empleo, con dos mil (2000) puestos de trabajo directos para la industria de API de la UE. La iniciativa ayudará a member states de la UE member states 3100 millones de euros en gastos sanitarios.
- Almacenamiento de alternativas más baratas de medicamentos patentados innovadores para que puedan entrar en el mercado inmediatamente después de la expiración de la Propiedad Intelectual (PI), mejorando el acceso de los pacientes.
Para un fabricante de medicamentos con sede fuera de la Unión Europea, la aplicación de la exención del CCP es una de las iniciativas más gratificantes a favor de los genéricos. Dado que la Autoridad Sanitaria de la UE regula los medicamentos para uso humano y veterinario mediante un procedimiento centralizado o descentralizado, navegar por los requisitos locales específicos puede resultar abrumador. Un experto, conocedor de los requisitos locales en materia de presentaciones y documentos de licencia, puede ayudarle a centrar sus esfuerzos en los protocolos de producción esenciales, en lugar de obsesionarse con los complejos obstáculos normativos. Reimagine el potencial de su negocio experimentando el cumplimiento normativo y la calidad. Póngase en contacto con Freyr.









