
Resumen Dispositivos Médicos en Turquía
Dispositivos Médicos turco Dispositivos Médicos ha experimentado un crecimiento significativo y constante durante la última década. A partir de 2021, Dispositivos Médicos en Turquía deberá cumplir con elReglamento (UE)2017/745 sobre productos sanitarios (MDR)yel Reglamento (UE)2017/746 sobre productos sanitarios para diagnóstico in vitro (IVDR). Esta mejora del comercio internacional ha llevado a varias empresas globales a lanzar sus dispositivos médicos en el país.
Autoridad reguladora: Agencia Turca de Medicamentos y Productos Sanitarios (TITCK)
Reglamento: Dispositivos Médicos (MDR) 2017/745, Reglamento sobre productos sanitarios para diagnóstico in vitro 2017/746
Vía reglamentaria: El marcado CE es obligatorio, seguido del registro/notificación en el Sistema de Seguimiento de Productos (UTS).
Turquía Representante local autorizado: Representante europeo autorizado (EAR) para fabricantes extranjeros (no UE/no Turquía)
Requisito del SGC: ISO 13485:2016
Evaluación de los datos técnicos: Organismo notificado para el marcado CE
Validez de la licencia: Sin límites
Formato de presentación: Papel
Traducción: Documentos traducidos al turco
Clasificación de los dispositivos
Turquía sigue la misma clasificación de productos sanitarios que el EU MDR y el IVDR de EU MDR . Determinar la clasificación de los productos sanitarios puede resultar complicado, por lo que es fundamental contar con el apoyo de un consultor con experiencia en materia de reglamentación.
Dispositivos Médicos -
| Clase | Riesgo |
|---|---|
| Clase I | Bajo |
| Clase IIa | Moderado |
| Clase IIb | Moderado a alto |
| Clase III | Alta |
Clases de dispositivos de diagnóstico in vitro -
| Clase | Riesgo |
|---|---|
| Clase A | Bajo |
| Clase B | Moderado |
| Clase C | Moderado a alto |
| Clase D | Alta |
Turquía Representante local autorizado
Ahora, gracias al acuerdo de unión aduanera, los fabricantes de la UE no necesitan nombrar a un representante local autorizado para comercializar sus productos.
Otros fabricantes extranjeros deben designar a un representante europeo autorizado (EAR ) para comercializar los dispositivos en el mercado turco.
Dispositivos Médicos
El marcado CE es una conformidad que exigen los fabricantes para colocar su dispositivo en el mercado turco. El marcado CE se expide mediante una evaluación de la conformidad realizada por el organismo notificado. Ahora, Turquía está autorizada a designar organismos notificados de conformidad con EU MDR y el IVDR de EU MDR .
Las empresas deben inscribirse en el Sistema Central de Registro (MERSIS) y registrar el dispositivo en el Sistema de Seguimiento de Productos (UTS).
Flujo del proceso
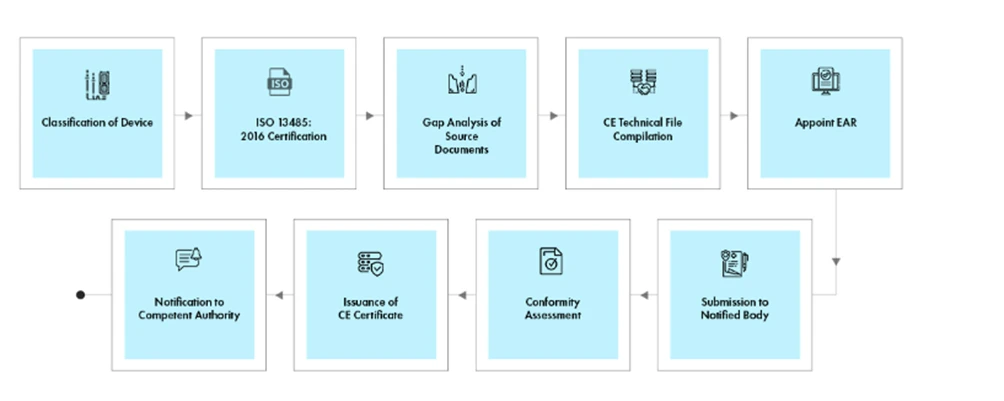
Gestión del ciclo de vida de los dispositivos tras su homologación
Freyr presta apoyo a fabricantes extranjeros en la gestión end-to-end Dispositivos Médicos , incluidas las actividades posteriores a la autorización, tales como:
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes, accesorios o indicaciones de uso, entre otras.
- Mantenimiento de las certificaciones ISO 13485:2016 y CE
- Renovación de licencias
- Enlace entre el organismo notificado y el fabricante
Dada la participación de diversos organismos de autorización, los fabricantes extranjeros deben cumplir con múltiples conjuntos de normativas en cada proceso individual para la aprobación de los dispositivos. Obtener el marcado CE y cumplir además con las normativas estatales requiere un amplio conocimiento normativo. En ocasiones, sin un socio normativo de confianza, navegar por todos los requisitos de los dispositivos puede resultar complicado para los nuevos participantes en el mercado. Para ayudar a los fabricantes, Freyr servicios end-to-end para agilizar las aprobaciones de los dispositivos médicos.
Experiencia Freyr
- Dispositivos Médicos europea de Dispositivos Médicos
- Apoyo del Representante Autorizado Europeo (EAR)
- Registro de dispositivos y notificación de productos en Turquía
- ISO 14971:2019 Consulta sobre gestión de riesgos
- Cumplimiento de la ISO 13485:2016
- Revisión, compilación y presentación del expediente técnico y de diseño de la CE
- Apoyo a la transición EU MDR
- Apoyo a la transición al IVDR de la UE
- Clinical Evaluation Reports (CER) de productos sanitarios
- Informes de evaluación del funcionamiento (PER) de los productos para diagnóstico in vitro
- Notificación/registro de productos sanitarios a través del sistema de registro en línea
- Informe sobre la estrategia Dispositivos Médicos
- Pruebas de biocompatibilidad, seguridad eléctrica, mecánica y rendimiento
- Apoyo al cumplimiento de las normas de etiquetado
- Apoyo GMP
- Apoyo a la vigilancia posterior a la comercialización

