
Resumen Dispositivos Médicos en Vietnam
Dispositivos Médicos de Vietnam está repuntando y actualmente es uno de los sectores en auge del país. Los dispositivos médicos en el país están regulados por el Departamento de Equipos Médicos y Obras Sanitarias (DMEHW) dependiente del Ministerio de Salud. Los fabricantes extranjeros deben designar a un representante local autorizado en Vietnam para que les ayude en el proceso Dispositivos Médicos en Vietnam.
Autoridad reguladora: Departamento de Equipamiento Médico y Obras Sanitarias (DMEHW)
Reglamento: Decreto núm. 98/2021/ CP
Representante autorizado: Vietnam Representante local autorizado
Requisito del SGC: ISO 13485:2016
Evaluación de los datos técnicos: Departamento de Equipos Médicos y Construcción (DMEC) del Ministerio de Sanidad
Labelling : Decreto núm. 111/2021
Formato de presentación: En línea- Plazos: 15 - 60 días
Idioma: Inglés y vietnamita
Dispositivos Médicos en Vietnam
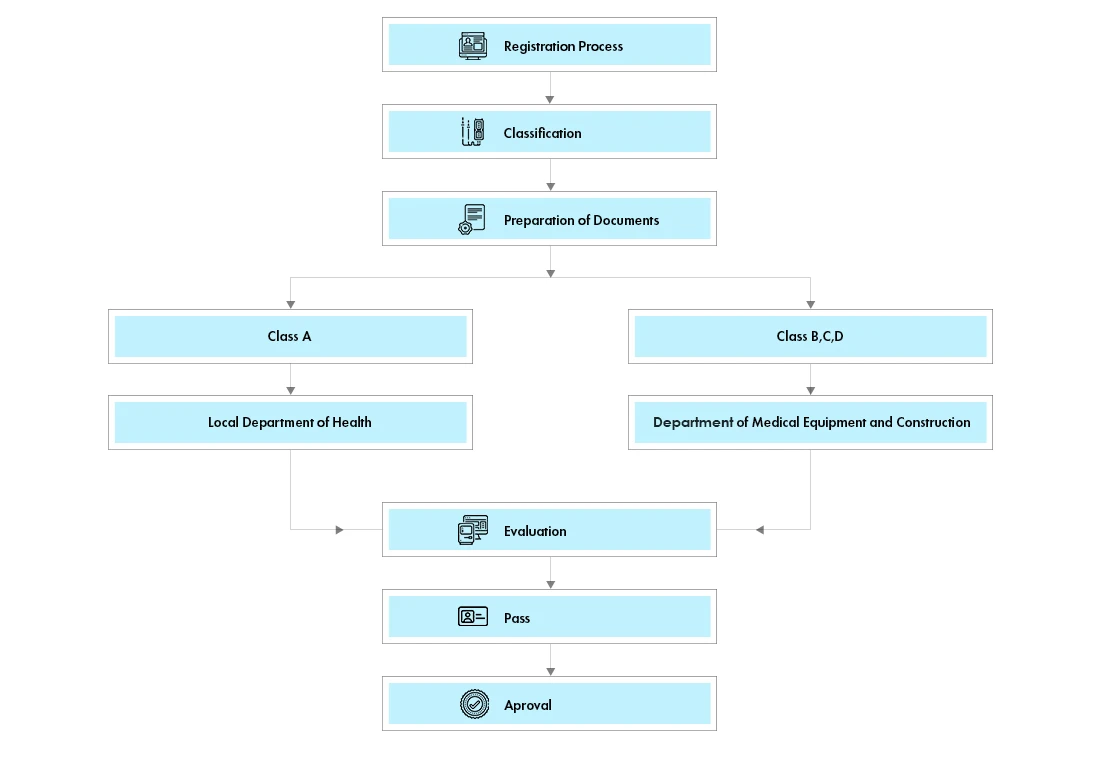
Los dispositivos se clasifican en 4 clases (A, B, C y D) que a su vez se clasifican en dos grupos, el grupo 1 (clase A) y el grupo 2 (clases B, C y D). La clasificación formal está disponible en el Departamento de Equipos Médicos y Obras Sanitarias de Vietnam (DMEHW).
| Grupo | Clase | Riesgo |
|---|---|---|
Grupo 1 | Clase A | Nivel bajo |
Grupo 2 | Clase B | Menor nivel medio de riesgo |
Clase C | Nivel medio superior de riesgos | |
Clase D | Alto nivel de riesgos |
Vietnam Representante local autorizado
La designación de un agente vietnamita fiable y capaz para los fabricantes extranjeros es crucial, ya que debe hacerse cargo de los servicios de garantía ofrecidos por el fabricante como parte de la venta del aparato. La traducción al vietnamita es imprescindible para entrar en la región, lo que en la práctica puede ser todo un reto.
Freyr ofrece asistencia normativa que abarca toda la gama de actividades, como la obtención del número de reconocimiento de libre venta necesario para Dispositivos Médicos por parte de las autoridades. También proporcionamos asistencia lingüística especializada para mantener intacta la perspectiva normativa de la traducción. Atendemos las necesidades posteriores a la aprobación de los clientes para mantener el cumplimiento normativo a lo largo del ciclo de vida del producto en Vietnam.
Vietnam Dispositivos Médicos
Todos los productos de las Clases A y B requerirán una Licencia de Autorización de Mercado (MA). Los productos de las clases A y B se someterán a una rápida revisión administrativa por parte del Departamento de Sanidad de la provincia en la que se encuentre el titular del registro.
A partir de ahora, los dispositivos de clase C y D deberán solicitar una licencia de autorización de comercialización (MA). Las licencias MA seguirán siendo válidas indefinidamente.
Flujo del proceso
Gestión del ciclo de vida de los dispositivos tras su aprobación
Freyr presta apoyo a los fabricantes extranjeros en la gestión end-to-end Dispositivos Médicos , incluidas las actividades posteriores a la autorización, tales como:
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes, accesorios o indicaciones de uso, entre otras.
- Mantenimiento de las autorizaciones y el registro mediante el pago puntual de las tasas administrativas y de registro.
- Renovación de licencias
- Enlace entre el DMEHW y el fabricante
- Gestión de las importaciones
Resumen
Grupo | Clase | Riesgo | Vía reglamentaria | Cronología | Validez |
|---|---|---|---|---|---|
Grupo 1 | Clase A | Nivel bajo | Declaración de la norma aplicable | 15 - 60 días | Sin límites |
Grupo 2 | Clase B | Menor nivel medio de riesgo | Certificado de registro de libre venta | 15 - 60 días | 5 años |
Clase C | Nivel medio superior de riesgos | Certificado de registro de libre venta | 15 - 60 días | 5 años | |
Clase D | Alto nivel de riesgos | Certificado de registro de libre venta | 15 - 60 días | 5 años |
Experiencia Freyr
- Diligencia debida reglamentaria
- Clasificación oficial
- Registro de dispositivos
- Licencia de importación
- Soporte de etiquetado
- Apoyo a la traducción
- Identificación y cualificación de distribuidores
- Vigilancia posterior a la comercialización
- Gestión de cambios tras la aprobación
- Renovación y transferencia de licencias
- Presentación y enlace
- Despacho de aduanas

