Resumen Dispositivos Médicos en Argentina
Argentina es uno de los países de América Latina que está experimentando un rápido desarrollo y que ofrece oportunidades a Dispositivos Médicos , con un sistema sanitario conocido por su dedicación a la seguridad de los pacientes y por la alta calidad de sus servicios médicos. Dispositivos Médicos en Argentina está supervisado por la autoridad reguladora, la Administración Nacional de Medicamentos, Alimentos y Trámites Médicos (ANMAT).

Autoridad Regulatoria: Administración Nacional de Medicamentos, Alimentos y Productos Sanitarios (ANMAT)
Reglamentos: Disposición 2318/2002, y Disposición 727/2013.
Vía reglamentaria: Sistema electrónico de notificación de dispositivos asistido por web (WAND)
Representante autorizado: Representante autorizado de Argentina (AAR)
Requisitos del SGC: ISO 13485 (ANMAT MDS), y MDSAP (Miembro Afiliado)
Evaluación de los datos técnicos: Administración Nacional de Medicamentos, Alimentos y Productos Sanitarios (ANMAT)
Requisitos de etiquetado: Anexo III.B de la Disposición 2318/2002 y Anexo V de la Disposición 727/2013.
Formato de presentación: Electrónico (portal HELENA)
Idioma: Español
Dispositivos Médicos en Argentina
En el proceso regulatorio de la ANMAT, el primer paso para determinar la vía de registro y el cumplimiento de la normativa argentina es determinar la clasificación de los Dispositivos Médicos. En Argentina, los dispositivos se clasifican en cuatro (04) clases en función del riesgo (Clase I-IV).
| Dispositivos Médicos | Criterios |
|---|---|
| Clase I | Riesgo bajo |
| Clase II | Riesgo bajo - moderado |
| Clase III | Riesgo alto - moderado |
| Clase IV | Alto riesgo |
| Clase IVD | Criterios |
|---|---|
| Clase A | Diagnóstico de enfermedades no infecciosas o no transmisibles. |
| Clase B | Diagnóstico de enfermedades infecciosas excepto las pertenecientes a la clase C. |
| Clase C | Diagnóstico de enfermedades infecciosas de transmisión sexual, o transmitidas por la sangre o sus derivados, así como para la identificación de grupos sanguíneos. |
| Clase D | Para la autoevaluación. |
Representante autorizado de Argentina (AAR)
El titular del registro de cualquier Dispositivos Médicos Argentina es legalmente responsable del registro y la comercialización del dispositivo en el país. Puede ser el fabricante del dispositivo o un representante autorizado local (AAR) en Argentina que actúe en nombre del fabricante.
Todos los productos sanitarios comercializados en Argentina deben estar registrados en la ANMAT. El proceso de registro puede ser complejo y llevar mucho tiempo, por lo que suele recomendarse que los fabricantes extranjeros designen a un AAR para que los asista.
Dispositivos Médicos ANMAT
El proceso Dispositivos Médicos de la ANMAT es similar a los procesos de notificación y registro brasileños, y el nivel de escrutinio para la aprobación aumenta en función de la clasificación del dispositivo (Clase I, II, III y IV). Todos Dispositivos Médicos también deben cumplir con la ANMAT-MDS, que es el equivalente argentino de la BGMP y también está en consonancia con ISO 13485:2016.
Flujo del proceso
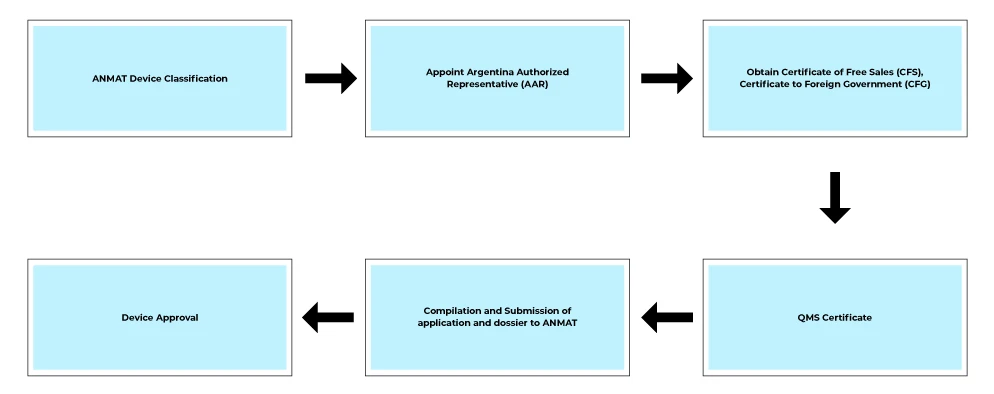
Servicios posteriores a la homologación
Freyr presta apoyo a fabricantes extranjeros con la gestión end-to-end del cicloDispositivos Médicos , incluidas las actividades posteriores a la aprobación, tales como:
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes, accesorios y nuevas indicaciones de uso, entre otras.
- Mantenimiento de las autorizaciones y el registro mediante el pago puntual de las tasas administrativas y de registro.
- Renovación de licencias.
- Enlace entre la ANMAT y el fabricante.
- Notificación de acontecimientos adversos.
- Gestión de las importaciones.
Freyr los fabricantes a identificar la clasificación de los dispositivos como primer paso. Freyr los clientes Freyr navegar por el camino normativo y a obtener certificaciones, ayudándoles a resolver los problemas normativos que ello conlleva. Con una experiencia demostrada en el lanzamiento de numerosos dispositivos en la región, Freyr servicios end-to-end para dispositivos médicos.
Resumen
| Clase de dispositivos | Vía de inscripción (notificación o inscripción completa) | Plazos de la Agencia de Salud | Validez del registro (años) |
|---|---|---|---|
| Dispositivos de clase I | Inscripción completa | 4- 6 meses | 5 años |
| Dispositivos de clase II | Inscripción completa | 4- 6 meses | 5 años |
| Dispositivos de clase III | Inscripción completa | 6-8 meses | 5 años |
| Dispositivos de clase IV | Inscripción completa | 6-8 meses | 5 años |
*Tenga en cuenta que factores como las limitaciones de ancho de banda, las actualizaciones normativas y otras variables pueden dar lugar a ampliaciones de los plazos de la Autoridad Sanitaria.
Experiencia Freyr
- Servicios de informes de inteligencia reglamentaria.
- Servicios Oficiales de Clasificación.
- Recopilación de documentos técnicos.
- Servicios de registro de dispositivos.
- Servicios de representante autorizado en Argentina (AAR).
- Servicios de importación.
- Permisos y autorizaciones de explotación.
- Servicios de traducción.
- Artwork de etiquetado y Artwork .
- Servicios de identificación y cualificación de distribuidores.
- Vigilancia posterior a la comercialización.
- Servicios de renovación y transferencia de licencias.