Resumen Dispositivos Médicos en Colombia
Colombia ofrece enormes oportunidades para Dispositivos Médicos y su sistema sanitario es conocido por su compromiso con la seguridad de los pacientes y la calidad de los servicios médicos. Los dispositivos médicos se regulan a través del INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos). El INVIMA es la autoridad operativa para Dispositivos Médicos en Colombia.

Autoridad reguladora: INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos)
Reglamento: Decreto 4725/2005
Vía reglamentaria: Registro de dispositivos
Representante autorizado: Representante legal en Colombia
Requisitos del SGC: ISO 13485:2016 / MDSAP
Evaluación de los datos técnicos: INVIMA
Requisitos de etiquetado: Los documentos de etiquetado deben estar en español
Validez de la licencia: 10 años
Formato de presentación: Electrónica
Dispositivos Médicos en Colombia
| Dispositivos Médicos | |
|---|---|
| Clase I (Riesgo más bajo) | |
| Clase IIa | |
| Clase IIb | |
| Clase III (Mayor riesgo) | |
Representante legal en Colombia
Para ser Representante Legal en Colombia, se debe tener la ciudadanía colombiana o poseer la autorización legal necesaria para residir y trabajar en el país como extranjero. Un Representante Legal puede asistir y gestionar todos los procedimientos de registro en Colombia, actuando como enlace entre la empresa y el INVIMA, la autoridad reguladora local.
Dispositivos Médicos en Colombia
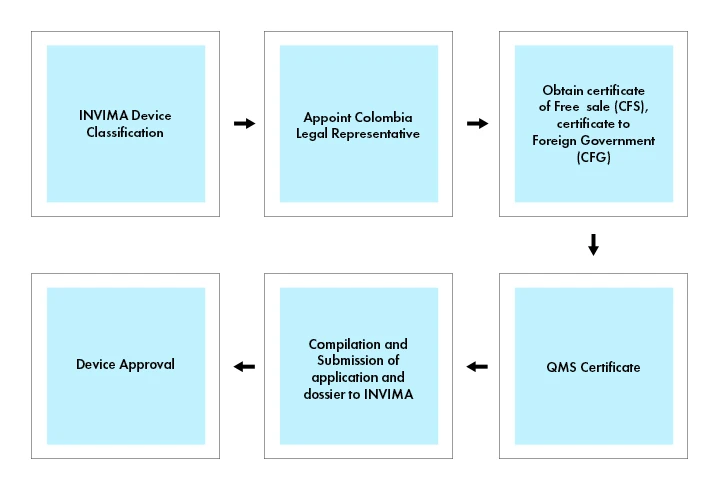
Los dispositivos médicos y los IVD están sujetos a un procedimiento de registro, por lo que Dispositivos Médicos registrarse en el INVIMA para poder comercializarse en Colombia.
Para comercializar un Dispositivos Médicos Colombia, es necesario obtener un Certificado de Libre Venta (CLV) o un Certificado para Gobiernos Extranjeros (CGE) expedido por la agencia reguladora correspondiente del país de origen o de un país de referencia reconocido (por ejemplo, Canadá, Japón, Australia, la Unión Europea y los Estados Unidos). El Certificado de Libre Venta o el Certificado para Gobiernos Extranjeros sirven como prueba de que los Dispositivos Médicos los estándares de seguridad y calidad necesarios para su venta en Colombia.
Flujo del proceso
Gestión del ciclo de vida de los dispositivos tras su aprobación
Freyr presta apoyo a los fabricantes extranjeros en la gestión end-to-end Dispositivos Médicos , incluidas las actividades posteriores a la autorización, tales como:
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes o accesorios, la incorporación de nuevas indicaciones de uso, entre otras.
- Mantenimiento de las autorizaciones y el registro mediante el pago puntual de las tasas administrativas y de registro.
- Renovación de licencias
- Enlace entre el INVIMA y el fabricante
Resumen
| Dispositivos Médicos | Nuevas licencias y renovaciones | ||
|---|---|---|---|
| Nuevo registro | Enmienda | Renovación | |
| Clase I | 4-6 meses | 2-3 meses | 4-6 meses |
| Clase IIa | 4-6 meses | 2-3 meses | 4-6 meses |
| Clase IIb | 4-6 meses | 2-3 meses | 4-6 meses |
| Clase III | 4-6 meses | 2-3 meses | 4-6 meses |
| Tasas de inscripción | |||||
|---|---|---|---|---|---|
| Nuevas licencias y renovaciones | Modificaciones técnicas | Modificaciones administrativas | |||
| Clase I y Clase IIa | Clase IIb y Clase III | Clase I y Clase IIa | Clase IIb y Clase III | Clase I y Clase IIa | Clase IIb y Clase III |
| $ 690,00 | $ 776,00 | $ 196,00 | $ 196,00 | $ 153,00 | $ 153,01 |
Experiencia Freyr
- Diligencia debida reglamentaria
- Clasificación oficial
- Registro de dispositivos
- Colombia Titular del registro
- Soporte de etiquetado
- Apoyo a la traducción
- Identificación y cualificación de distribuidores
- Vigilancia posterior a la comercialización
- Gestión de cambios tras la aprobación
- Renovación y transferencia de licencias
- Presentación y enlace con el INVIMA