Resumen Dispositivos Médicos en Egipto
Desde septiembre de 2018, Dispositivos Médicos es obligatorio en Egipto. Dispositivos Médicos en el país ha experimentado un crecimiento constante, lo que la convierte en un mercado atractivo para fabricantes y distribuidores. Con una valoración de 4000 millones de dólares en 2021, se prevé que el mercado egipcio de dispositivos médicos alcance una tasa de crecimiento anual compuesta (CAGR) superior al 3 % entre 2022 y 2027. Las importaciones satisfacen en gran medida la demanda de dispositivos médicos en Egipto, dada la producción local relativamente baja. Cabe destacar que el mercado egipcio de dispositivos médicos es el segundo más grande de la región de Oriente Medio y Norte de África (MENA). En esta descripción general se exploran los aspectos clave del proceso de registro egipcio y se ofrece información sobre el marco normativo y los requisitos para situar los dispositivos médicos innovadores a la vanguardia del sector sanitario egipcio.
Autoridad reguladora: Autoridad Egipcia de Medicamentos (AED)
Regulación: Dispositivos Médicos egipcia sobre Dispositivos Médicos Ley n.º 10 de 2003
Vía reglamentaria: Registro del producto (normal y rápido) y clasificación oficial
Egipto Representante local autorizado: Titular del registro egipcio (ERH)
Requisitos del SGC: ISO 13485
Evaluación de datos técnicos: El Centro de Política y Planificación de Medicamentos (DPPC) y la Administración Central de Asuntos Farmacéuticos (CAPA).
Validez de la licencia: Diez (10) años
Formato de presentación: Papel y electrónico
Traducción: Documentos traducidos al árabe y al inglés
Clasificación de los dispositivos
En Egipto, Dispositivos Médicos se ajusta al sistema europeo de clasificación, que categoriza los dispositivos médicos en función de su uso previsto y los riesgos potenciales asociados a su uso. Los fabricantes deben identificar la clasificación correcta de sus dispositivos para garantizar el cumplimiento de los requisitos reglamentarios y obtener las autorizaciones necesarias para su comercialización y distribución en Egipto.
Dispositivos Médicos
| Clase | Riesgo |
|---|---|
| Clase I | Bajo |
| Clase II a | Bajo-Medio |
| Clase II b | Medio-Alto |
| Clase III | Alta |
Egipto Representante local autorizado
Dispositivos Médicos con sede fuera de Egipto deben designar a un agente local denominado «titular del registro egipcio (ERH)» para que se encargue de presentar las solicitudes de registro y los expedientes a la EDA en su nombre. El ERH actúa como enlace entre el fabricante y la autoridad reguladora, garantizando la preparación y presentación correctas de toda la documentación necesaria y verificando que los Dispositivos Médicos las normas de seguridad, calidad y eficacia de la EDA. Además, el ERH es responsable de conservar la documentación de registro, informar de incidentes o retiradas y garantizar el cumplimiento continuo de todas las normas y reglamentos aplicables a lo largo del ciclo de vida del dispositivo. El Titular del Registro Egipcio (ERH) es totalmente responsable de garantizar el registro de un Dispositivos Médicos la EDA, en particular en la Administración Central de Dispositivos Médicos. Esta función implica garantizar el cumplimiento por parte del dispositivo de los requisitos reglamentarios de la EDA para su comercialización y distribución en Egipto.
Dispositivos Médicos
La obtención de la autorización de comercialización para un Dispositivos Médicos Egipto comprende varios pasos, entre los que se incluyen la preparación de la documentación necesaria, la presentación de la solicitud a la EDA, el cumplimiento de los requisitos de clasificación y del sistema de calidad, el nombramiento de un ERH si es necesario y el cumplimiento de las obligaciones posteriores a la comercialización. El proceso de registro es fundamental para garantizar que los dispositivos médicos se ajusten a las normas de seguridad, calidad y eficacia establecidas por la autoridad reguladora egipcia. La documentación necesaria puede variar en función de la vía de registro elegida, pero generalmente incluye lo siguiente:
- Certificado CE (si procede).
- Certificado de Libre Venta (CFS).
- Certificación ISO 13485 .
- Declaración de conformidad (DOC).
Flujo de procesos
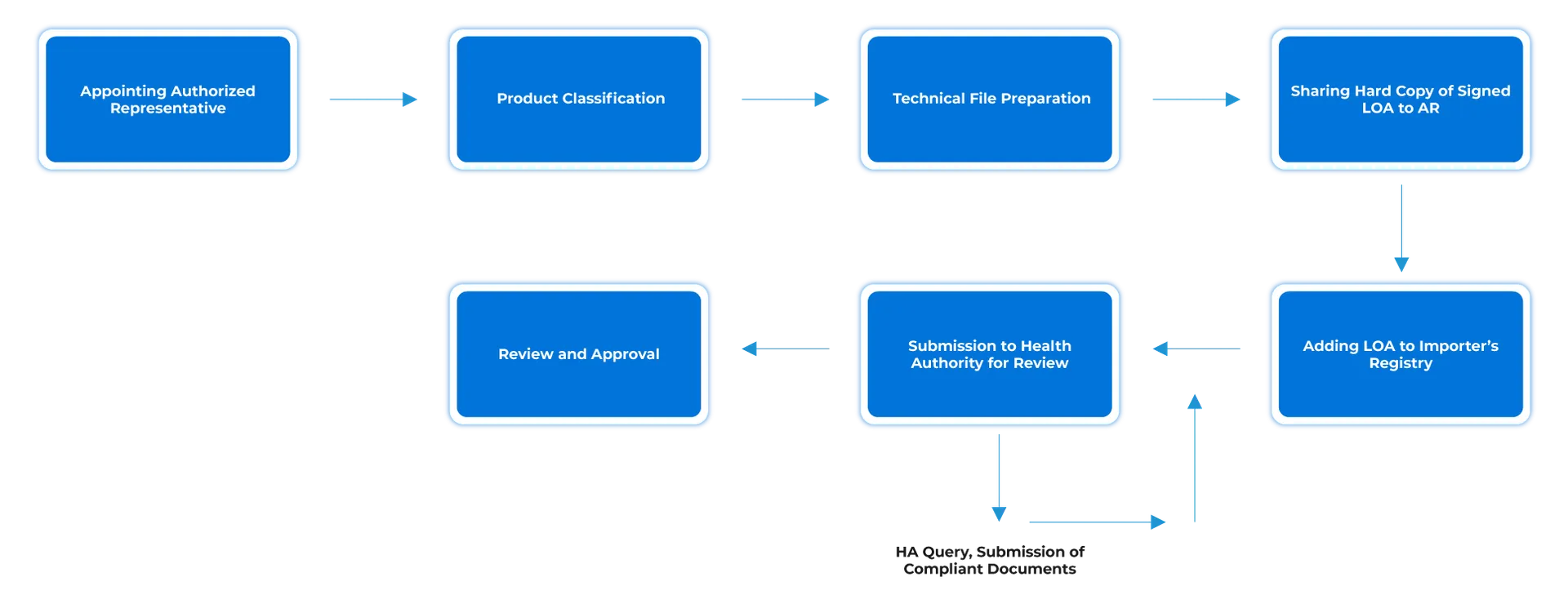
Gestión del ciclo de vida de los dispositivos tras su homologación
Freyr presta un apoyo integral a los fabricantes extranjeros en la gestión de todo el ciclo de vida de los productos sanitarios en Egipto, incluidas las actividades posteriores a la homologación:
- Gestión de cambios posteriores a la aprobación, que aborda las modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes, accesorios e indicaciones de uso.
- Mantenimiento de la ISO 13485:2016.
- Certificación CE.
- Actuar como intermediario entre el Organismo Notificado (ON) y el fabricante.
- Un sistema de vigilancia para supervisar la seguridad de los Dispositivos Médicos se les haya concedido la autorización de comercialización.
- Proporcionar actualizaciones periódicas sobre la seguridad y eficacia de los Dispositivos Médicos, así como sobre cualquier cambio en la situación normativa en otras jurisdicciones.
- Renovación de la autorización de comercialización, en función del tipo de producto y de la normativa, tras un periodo determinado.
La gestión eficaz de Post-market Surveillance (PMS) Egipto implica navegar con destreza por los marcos normativos establecidos por la EDA. Las empresas que se incorporan al mercado y se enfrentan a estas complejidades, y que carecen de un socio normativo consolidado, pueden aprovechar los amplios servicios normativos que ofrece Freyr. Estos servicios contribuyen a un proceso de aprobación fluido para los productos sanitarios en Egipto, garantizando el cumplimiento continuo del panorama normativo y la dinámica del mercado en constante evolución.
Dispositivos Médicos en Egipto Experiencia
- Inteligencia normativa.
- Diligencia debida reglamentaria.
- Dispositivos Médicos .
- Registro del dispositivo.
- Titular del registro egipcio.
- Apoyo a la traducción.
- Redacción médica.
- Apoyo al etiquetado.
- Identificación y cualificación de distribuidores.
- Gestión de cambios tras la aprobación.
- Renovación y transferencia de licencias.
- Despacho de aduanas.
