Resumen Dispositivos Médicos en Israel
Dispositivos Médicos de Israel está experimentando un crecimiento y una innovación sostenidos, lo que la convierte en un centro neurálgico para las tecnologías sanitarias de vanguardia. El registro de los dispositivos médicos es fundamental para las empresas que se incorporan a este dinámico mercado. En esta descripción general se analizan los aspectos clave del proceso de registro en Israel y se ofrece información sobre el marco normativo y los requisitos para situar los dispositivos médicos innovadores a la vanguardia del sector sanitario israelí.
Autoridad reguladora: Dispositivos Médicos de Dispositivos Médicos del Ministerio de Salud de Israel (AMAR).
Regulación: Ley deDispositivos Médicos de 2012
Vía reglamentaria: Registro del producto
Representante local autorizado de Israel: Israel Registration Holder (IRH)
Requisitos del SGC: ISO 13485
Evaluación de los datos técnicos: El Departamento de Productos Sanitarios del Ministerio de Sanidad
Validez de la licencia: Cinco (05) años
Formato de presentación: Papel y electrónico
Traducción: Documentos traducidos al hebreo
Clasificación de los dispositivos
La Ley de Equipos Médicos y el Reglamento para el Registro de Equipos Médicos en Israel no especifican un sistema de clasificación de riesgos. En su lugar, Israel alinea su Dispositivos Médicos con las normas internacionales, en particular las establecidas por los países del Grupo de Trabajo para la Armonización Global (GHTF). Alternativamente, se adopta la clasificación de riesgo de un dispositivo en un país reconocido para su registro en Israel. Este proceso de clasificación suele tener en cuenta el uso previsto, el nivel de riesgo y otros factores que pueden afectar a la seguridad y la eficacia de los dispositivos médicos.
Dispositivos Médicos
| Clase | Riesgo |
|---|---|
| Clase I | Bajo |
| Clase II | Bajo-Medio |
| Clase III | Alta |
Cambios propuestos en las vías de registro
Las modificaciones propuestas se aplican a los productos de las clases I y II, mientras que el sistema de registro de los productos de la clase III se mantiene sin cambios.
- Los productos de la clase I pueden registrarse inmediatamente mediante autodeclaración.
- En el caso de los dispositivos de clase II, aunque se requieren declaraciones y documentos técnicos, AMAR puede acelerar el proceso a catorce (14) días para aquellos que se consideren de riesgo bajo-medio. Esto se aplica si el fabricante cuenta con dos (02) autorizaciones de países reconocidos y proporciona seis (06) meses de datos de mercado. Alternativamente, para los dispositivos de clase II que solo cuentan con la autorizaciónFDA (k)FDA US y seis (06) meses de datos US , el tiempo de tramitación de AMAR se acelera a sesenta (60) días.
Representante local autorizado de Israel
Dispositivos Médicos con sede fuera de Israel deben designar a un titular de registro israelí (IRH) para facilitar el registro de sus productos para su venta en el país. El IRH actúa como representante local del fabricante y se encarga de servir de enlace con el Ministerio de Sanidad para garantizar el cumplimiento de la normativa local. Además, el IRH es responsable de establecer y mantener una presencia comercial en Israel, así como de obtener y mantener una licencia comercial válida.
Dispositivos Médicos
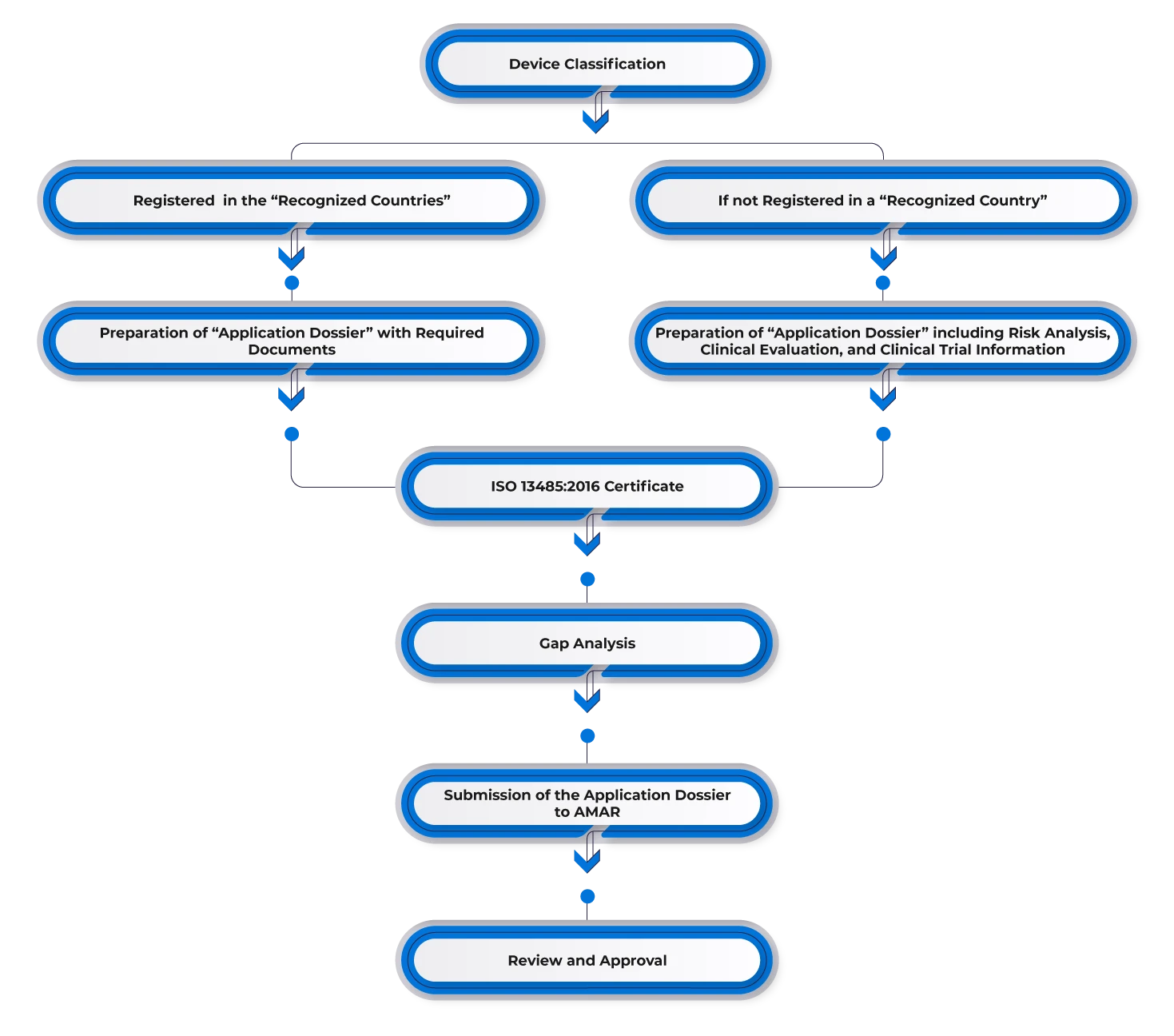
Para registrar un Dispositivos Médicos Israel, los fabricantes deben obtener la aprobación previa en uno de los mercados de referencia, como Estados Unidos, Europa, Australia, Canadá u otros mercados importantes. Los fabricantes que ya cuenten con aprobaciones en uno de los países de referencia pueden utilizar dicha aprobación para el mercado israelí y designar a un representante en el país. Posteriormente, deben presentar la documentación requerida, que incluye:
- FDA 510(k)/Carta de aprobación de precomercialización/CE.
- Certificado a Gobierno Extranjero (CFG)/Certificado de Libre Venta (CFS).
- Certificación ISO 13485 u otra certificación reconocida de buenas prácticas de fabricación (BPF).
- Validación y certificación del Instituto de Normalización de Israel (si es necesario).
Flujo de procesos
Gestión del ciclo de vida de los dispositivos tras su homologación
Freyr presta un apoyo integral a los fabricantes extranjeros en la gestión de todo el ciclo de vida de los productos sanitarios en Israel, incluidas las actividades posteriores a la homologación:
- Gestión de cambios posteriores a la aprobación, que aborda las modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes, accesorios e indicaciones de uso.
- Mantenimiento de las certificaciones ISO 13485:2016 y CE.
- Renovación de licencias.
- Actuar como intermediario entre el Organismo Notificado (ON) y el fabricante.
Navegar por las complejidades de los organismos de autorización y cumplir con múltiples conjuntos de normativas para la aprobación de dispositivos puede resultar complicado. Obtener las aprobaciones de varios países del GHTF y cumplir con las normativas estatales requiere un profundo conocimiento normativo. Para los nuevos participantes en el mercado que se enfrentan a estas complejidades sin un socio normativo establecido, Freyr ofrece servicios end-to-end , agilizando el proceso de aprobación de dispositivos médicos en Israel.
Dispositivos Médicos en Egipto Experiencia
- Dispositivos Médicos de Israel.
- Titular del Registro Israelí (IRH).
- Registro de dispositivos de Israel.
- ISO 14971:2019 Consulta sobre gestión de riesgos.
- Cumplimiento de la ISO 13485:2016.
- Revisión, compilación y presentación del expediente de diseño.
- Registro de productos sanitarios a través del sistema de registro en línea.
- Informe sobre la estrategia Dispositivos Médicos .
- Soporte de pruebas: biocompatibilidad, seguridad eléctrica, mecánica y rendimiento.
- Apoyo al cumplimiento de las normas de etiquetado.
- Soporte GMP.
- Post-market Surveillance (PMS) .
