Dispositivos Médicos en los Emiratos Árabes Unidos: descripción general
Los Emiratos Árabes Unidos (EAU), un destacado miembro del CCG, cuentan con un sistema sanitario avanzado. Su potencial de mercado está demostrado y en constante crecimiento, regulado por el Departamento de Control de Medicamentos del Ministerio de Salud y Prevención (MOHAP). La gobernanza centralizada y las barreras lingüísticas son los principales obstáculos para Dispositivos Médicos en los EAU, junto con las complejidades lingüísticas y la falta de canales de comunicación eficientes con las autoridades sanitarias.
Autoridad reguladora: Departamento de Control de Drogas del Ministerio de Sanidad y Prevención (MOHAP)
Reglamento: Directrices para el registro de productos sanitarios en los EAU
Vía reglamentaria: Registro de productos
Representante autorizado: Se requiere un representante local autorizado de los EAU
Requisito del SGC: ISO 13485:2016
Evaluación de los datos técnicos: Comité Dispositivos Médicos
Validez de la licencia: 5 años
Requisitos de etiquetado: Anexo 2 (2.5) de la Directriz de registro de productos sanitarios de los EAU
Formato de presentación: Papel
Idioma: Inglés
Dispositivos Médicos de los Emiratos Árabes Unidos
Los Emiratos Árabes Unidos tienen normas de clasificación separadas para los productos sanitarios y los productos para diagnóstico in vitro. Las normas Dispositivos Médicos de los Emiratos Árabes Unidos se ajustan a las normas de clasificación de Dispositivos Médicos de la UE Dispositivos Médicos . Las clases de productos según las normas de clasificación de los Emiratos Árabes Unidos son las siguientes:
| Criterios de riesgo | Dispositivos Médicos |
|---|---|
| Riesgo bajo | I |
| Riesgo bajo moderado | IIa |
| Riesgo moderado - alto | IIb |
| Alto riesgo | III |
| Criterios de riesgo | Clase IVD |
|---|---|
| Bajo riesgo individual y bajo riesgo para la salud pública | A |
Riesgo individual moderado y/o bajo riesgo para la salud pública | B |
Alto riesgo individual y/o Riesgo moderado para la salud pública | C |
| Alto riesgo individual y alto riesgo para la salud pública | D |
Representante local autorizado de los EAU
Los Fabricantes Extranjeros, sin oficina física, deberán designar a un Representante Local (RL) para que actúe en su nombre. El representante local deberá estar autorizado por el Ministerio de Sanidad como almacén médico u oficina científica (en caso de oficina científica, las actividades de importación y distribución deberán ser realizadas por un Almacén Médico Autorizado designado). Los solicitantes pueden designar a su distribuidor como Representante Local. Sin embargo, tener un Representante Local independiente, sin intereses comerciales, proporcionaría la flexibilidad necesaria para designar múltiples distribuidores en los EAU. Los datos del representante local y del distribuidor deben facilitarse durante el registro del producto.
Clasificación oficial Proceso con el MoHAP de los EAU
El MoHAP de los EAU ha introducido un servicio oficial de clasificación, especialmente útil cuando no está seguro de si su producto requiere registro. Este servicio clasifica productos de todo tipo y forma en función de su presentación, composición, uso y diseño. Los requisitos pueden variar en función de la naturaleza del producto, la clase de riesgo y la situación reglamentaria.
La carta de clasificación indica si es necesario registrar un producto en el MOHAP. Si es necesario registrarlo, el producto debe registrarse de acuerdo con la clase identificada en la carta de clasificación. Esta carta tiene una validez de tres años a partir de la fecha de expedición.
Los resultados de la clasificación oficial pueden ser:
- No requiere inscripción en el MOHAP
- Autorizado por el Ministerio de Salud y Asistencia Social de los Emiratos Árabes Unidos como Dispositivos Médicos, restringido al uso profesional.
- Autorizado por el Ministerio de Salud y Asistencia Social de los Emiratos Árabes Unidos como Dispositivos Médicos de venta libre.
Dispositivos Médicos en los Emiratos Árabes Unidos
Determinados Dispositivos que no requieren registro de producto o listado o aprobación previa para su importación. Dichos productos exentos de registro o listado deberán solicitar y obtener un permiso de Importación para ser comercializados en EAU.
Para otros dispositivos, las importaciones no se despacharán a menos que la DRCD emita una aprobación previa para la importación del envío. Dichos dispositivos deberán figurar en una lista o estar registrados para su importación en los EAU.
Listado de productos: Por lo general, los productos utilizados en hospitales bajo supervisión profesional y los productos de clase I no se someten a una evaluación detallada y deben figurar en la lista. La agencia emitirá un Certificado de Listado. Una vez incluidos en la lista, los productos deberán obtener un permiso de importación para comercializarse en los EAU.
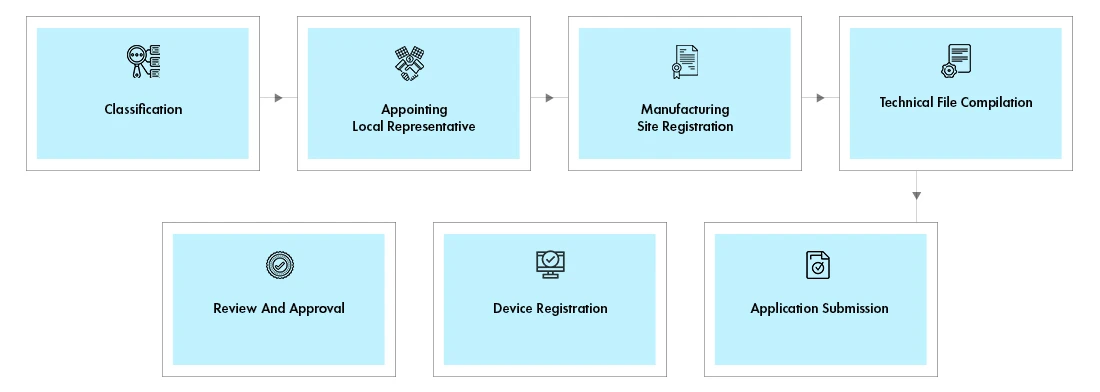
Registro de dispositivos: La actividad de Registro incluye el Registro del Sitio y del Producto.
- Registro del sitio:El sitio de fabricación debe estar registrado, si el dispositivo fabricado en ese sitio se importa a los EAU por primera vez. Para los siguientes dispositivos fabricados en el mismo sitio, sólo el registro del dispositivo sería suficiente, y el registro del sitio no es necesario.
- Registro de dispositivos:Estos dispositivos están sujetos a revisión por parte del comité técnico que, tras su aprobación, otorgará un certificado de licencia.
Flujo del proceso
Gestión del ciclo de vida de los dispositivos tras su aprobación
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes, accesorios o indicaciones de uso, entre otras.
- Mantenimiento de las autorizaciones y el registro mediante el pago puntual de las tasas administrativas y de registro.
- Renovación de licencias
- Enlace entre el Ministerio de Sanidad y el fabricante
- Gestión de la importación
Con un centro de distribución exclusivo en Dubái, Freyr tiene una posición dominante en el Dispositivos Médicos de los Emiratos Árabes Unidos y describe la clasificación de los dispositivos, además de descifrar las normas de orientación para un mejor cumplimiento. Ayudamos a los clientes a recopilar la documentación según las normas y, de este modo, garantizamos una rápida aprobación. Freyr ofrece una gama completa de servicios normativos relacionados con la comercialización exitosa de dispositivos.
Resumen
| Tipo de dispositivo | Lista de dispositivos | Registro de dispositivos | Licencia de importación |
|---|---|---|---|
Dispositivo exento de autorización previa a la importación (Según la lista del anexo 3) | NA | NA | SÍ |
| SÍ | NA | SÍ |
| Todos los demás dispositivos | NA | SÍ | SÍ |
Experiencia Freyr
- Inteligencia Reglamentaria
- Diligencia debida reglamentaria
- Dispositivos Médicos formal de Dispositivos Médicos
- Registro de dispositivos
- Representación autorizada de los EAU
- Apoyo a la traducción
- Soporte de etiquetado
- Identificación y cualificación de distribuidores
- Gestión de cambios tras la aprobación
- Renovación y transferencia de licencias
- Despacho de aduanas