Resumen Dispositivos Médicos en Nueva Zelanda
En Nueva Zelanda, los productos sanitarios están regulados por la Autoridad neozelandesa de Seguridad de Medicamentos y Productos Sanitarios (Medsafe), de acuerdo con el Reglamento de Medicamentos de 1984, la Ley de Medicamentos de 1981 y el Reglamento de Medicamentos (Base de Datos de Productos Sanitarios) de 2003. Aunque no es necesaria la aprobación previa a la comercialización, sí lo es la inclusión de los productos en la base de datos del sistema electrónico de notificación asistida por web (WAND) en un plazo de 30 días a partir del lanzamiento comercial. Medsafe puede solicitar documentación que demuestre la seguridad y eficacia, como la certificación de organismos reconocidos, como un organismo notificado de la UE o Health Canada.
El equipo de expertos Dispositivos Médicos de Freyr cuenta con una amplia experiencia en guiar a Dispositivos Médicos a través del proceso de registro de Medsafe para dispositivos médicos en Nueva Zelanda.

Autoridad reguladora: Autoridad de Seguridad de los Productos Sanitarios (Medsafe)
Reglamento:The Medicines (Database of Medical Devices) Regulations, 2003
Ley de Medicamentos de 1981
Reglamento de Medicamentos de 1984
Vía reglamentaria: Sistema electrónico de notificación de dispositivos asistido por web (WAND)
Representante autorizado: Dispositivos Médicos
Requisito del SGC: Certificación ISO 13485:2016
Evaluación de los datos técnicos: Autoridad de Seguridad de los Productos Sanitarios (Medsafe)
Validez de la licencia: Los listados de productos en Nueva Zelanda no caducan. Los dispositivos que se considere que suponen una amenaza importante para el público pueden ser retirados del mercado.
Requisitos de etiquetado: Regulación 12(4) del Reglamento sobre Medicamentos de 1984 y GHTF/SG1/N43:2005
Formato de presentación: Sistema electrónico de notificación de dispositivos asistido por web (WAND)
Idioma: Inglés
Dispositivos Médicos de Nueva Zelanda
Los dispositivos médicos en Nueva Zelanda se clasifican por riesgo en las clases I, IIa, IIb, III y AIMD, de acuerdo con los criterios del Foro Internacional Dispositivos Médicos (IMDRF). Esta clasificación afecta al nivel de control regulatorio necesario. La clasificación se basa en características como la finalidad prevista del dispositivo, la duración del contacto con el cuerpo, el grado de invasividad y si es activo o inactivo. Los dispositivos de clase superior están sujetos a una supervisión reglamentaria más estricta. Medsafe es la entidad reguladora de Nueva Zelanda que supervisa estas clasificaciones y reglamentos.
| Dispositivos Médicos de Medsafe Dispositivos Médicos distinta a la clase IVD. | Riesgo |
|---|---|
| Clase I Básica | Riesgo bajo |
| Medición de clase I | Riesgo bajo |
| Clase I estéril | Riesgo bajo |
| Clase IIa | Riesgo bajo-medio |
| Clase IIb | Riesgo medio-alto |
| Dispositivos Médicos implantables activos (AIMD) y de clase III | Alto riesgo |
| Clasificación Medsafe IVD | Riesgo |
|---|---|
| Desde julio de 2014, Medsafe no reconoce ningún sistema de clasificación de riesgos para los DIV. Todos los DIV notificados a WAND deben utilizar el código de clasificación de riesgos del DIV. El Director General de Sanidad autorizó la exención para los IVD de acuerdo con el Anexo 1, párrafo (i) del Reglamento de Medicamentos (Base de Datos de Productos Sanitarios) de 2003. Pero los proveedores de DIV pueden notificar voluntariamente sus dispositivos a la base de datos. | |
Representante Dispositivos Médicos /patrocinador de Dispositivos Médicos
El representante autorizado se denomina patrocinador y actúa como intermediario entre el fabricante y Medsafe. Los patrocinadores actúan como representantes normativos de los productos que se comercializan en Nueva Zelanda, presentan solicitudes WAND y son el principal punto de contacto entre el fabricante y Medsafe para todos los asuntos relacionados con el producto. Además, Medsafe responsabiliza al patrocinador de los esfuerzos de vigilancia.
Dispositivos Médicos en Nueva Zelanda
Dispositivos Médicos , el procedimiento de Nueva Zelanda y el procedimiento de inclusión en la lista WAND en Nueva Zelanda varían según la clase del dispositivo.
Dispositivos de clase I: se requiere una declaración de conformidad del fabricante para los equipos de clase I no estériles y no de medición; sin embargo, rara vez se presenta a un organismo regulador. En su lugar, el patrocinador (o proveedor) debe introducir los detalles del dispositivo en la base de datos de Notificación Asistida por Web de Dispositivos (WAND) como parte del proceso de notificación Medsafe.
Otros dispositivos de clase
En Nueva Zelanda, los patrocinadores o proveedores tienen la tarea de garantizar que los productos sanitarios cumplen normas como ISO 13485:2016. Normalmente no se exige la presentación directa de una declaración de conformidad, una certificación del SGC o pruebas de fabricación a Medsafe. Sin embargo, conservar esta documentación es crucial para demostrar el cumplimiento cuando se solicite.
Medsafe da prioridad a la vigilancia posterior a la comercialización frente a la aprobación detallada previa a la comercialización de productos sanitarios. Aunque las auditorías no se realizan de forma rutinaria durante la fase de notificación, Medsafe puede iniciarlas en el caso de dispositivos de alto riesgo o tras actividades de vigilancia e informes de eventos adversos, garantizando la seguridad y el cumplimiento continuos.
Una vez que un dispositivo se notifica a través de la base de datos WAND, puede comercializarse en Nueva Zelanda, siempre que el proveedor cumpla sistemáticamente con las normativas de Medsafe. Esto exige un cumplimiento continuo, especialmente en lo que respecta a la supervisión posterior a la comercialización y las normas de notificación de incidentes. Los Dispositivos Médicos de Freyr prestan servicios de asistencia relacionados con el cumplimiento de estos requisitos normativos, garantizando que las empresas mantengan el cumplimiento a lo largo de todo el ciclo de vida del producto.
Flujo del proceso
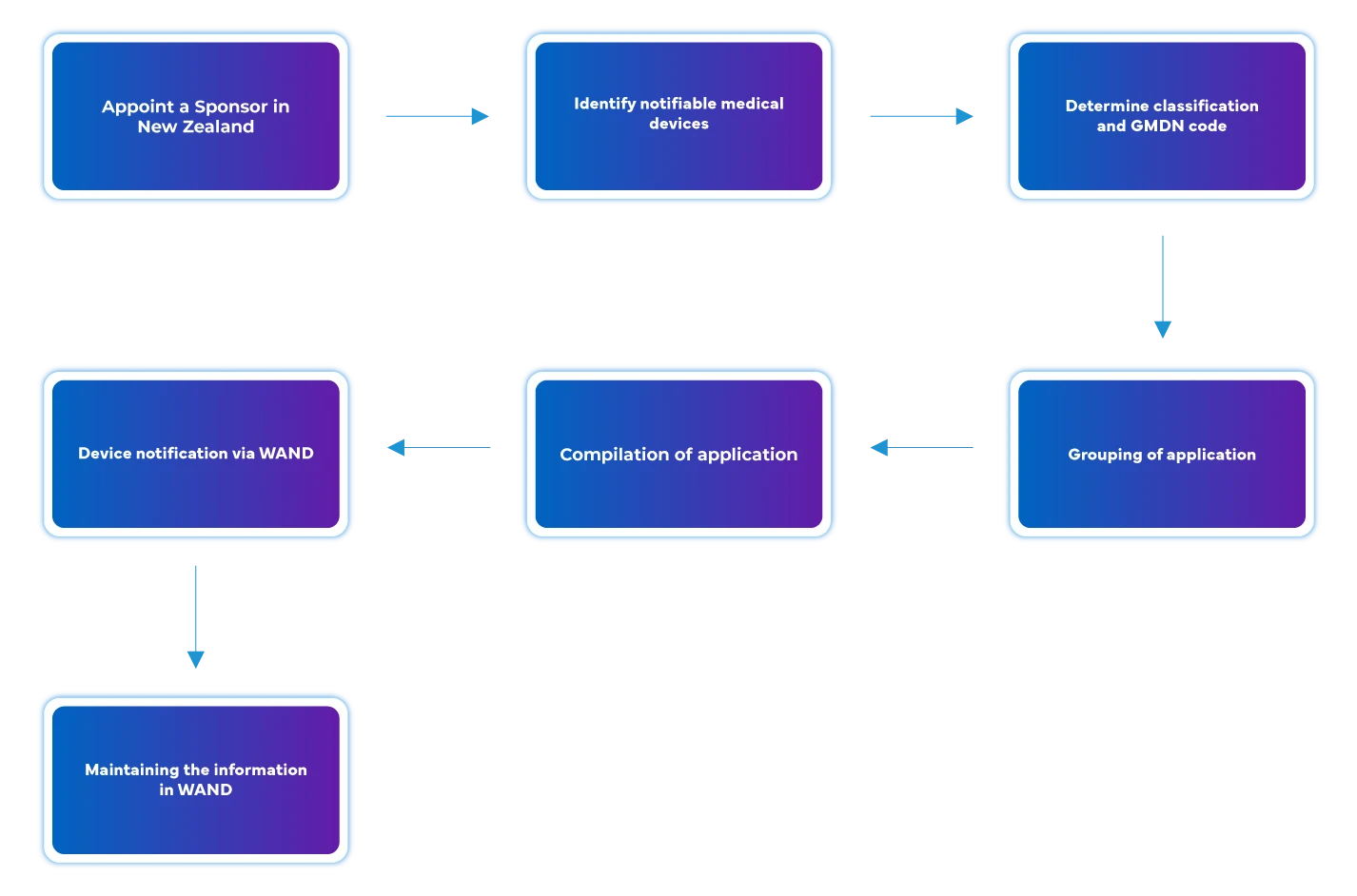
Gestión del ciclo de vida de los dispositivos tras su aprobación
Freyr presta apoyo a fabricantes extranjeros en la gestión end-to-end Dispositivos Médicos , incluidas las actividades posteriores a la aprobación, mediante la notificación a las autoridades neozelandesas a través de WAND, tales como:
- Gestión de cambios posteriores a la aprobación: modificaciones de Dispositivos Médicos existentes Dispositivos Médicos , como la incorporación de nuevas variantes o accesorios, la incorporación de nuevas indicaciones de uso, entre otras.
- Mantenimiento de homologaciones y registros.
Dotada de un equipo de profesionales de la reglamentación, Freyr ofrece apoyo integral a los fabricantes para mantener las normas de calidad y seguridad necesarias para la aprobación del mercado. Los especialistas en inteligencia reglamentaria de la empresa supervisan meticulosamente las actualizaciones de la normativa, garantizando que los clientes estén bien informados sobre las medidas necesarias para mantener la conformidad de sus productos con las normas vigentes.
Resumen
| Riesgo | Clase de dispositivo | Auditoría del SGC | Vía reglamentaria | Plazos Medsafe | Validez del registro (años) |
|---|---|---|---|---|---|
| Riesgo bajo | Clase I Básica | Cumplimiento de ISO 13485:2016 Nota: Medsafe no exige auditorías del SGC, pero recomienda encarecidamente seguir ISO 13485:2016 en materia de calidad y seguridad. Medsafe tiene autoridad para realizar auditorías del SGC para cualquier clase de dispositivo si surgen problemas de seguridad o calidad. | Listado WAND (Notificación) | 1 semana |
Sin fecha de caducidad |
| Riesgo bajo | Medición de clase I | Listado WAND (Notificación) | |||
| Riesgo bajo | Clase I estéril | Listado WAND (Notificación) | |||
| Riesgo bajo-medio | Clase IIa | Listado WAND (Notificación) | |||
| Riesgo medio-alto | Clase IIb | Listado WAND (Notificación) | |||
| Alto riesgo | Clase III | Listado WAND (Notificación) |
Nota: De acuerdo con la legislación vigente, las listas de dispositivos de Nueva Zelanda no caducan, pero los dispositivos que se considere que plantean un riesgo inaceptable para el público pueden ser retirados del mercado. Sin embargo, la legislación actual podría revisarse en 2026/2027.
Experiencia Freyr
- Asistencia integral para Dispositivos Médicos .
- Soporte LR
- Listado WAND
- Soporte de etiquetado
- Gestión de cambios tras la aprobación
- Transferencia de licencia
- Servicios de presentación y enlace con WAND
