Visión general del eSTAR de FDA
La iniciativa eSTAR de FDA se formuló para mejorar la eficacia y uniformidad en la preparación y evaluación de las solicitudes 510(k) y De Novo de FDA . Partiendo del enfoque inicial de eSubmitter, que implicaba la presentación electrónica de solicitudes de dispositivos médicos y DIV, se estableció el programa eSTAR, aprovechando la experiencia previa de la FDA. La FDA fue pionera en un programa diferente denominado Programa piloto de plantillas y recursos para la presentación electrónica (eSTAR). A partir del 1 de octubre de 2023, las presentaciones 510(k) (Tradicional, Abreviada o Especial 510[k]) tendrán que utilizar el programa eSTAR. Las plantillas están disponibles para su acceso en línea, aunque requieren el uso de credenciales de cuenta FDA para el proceso de presentación real.
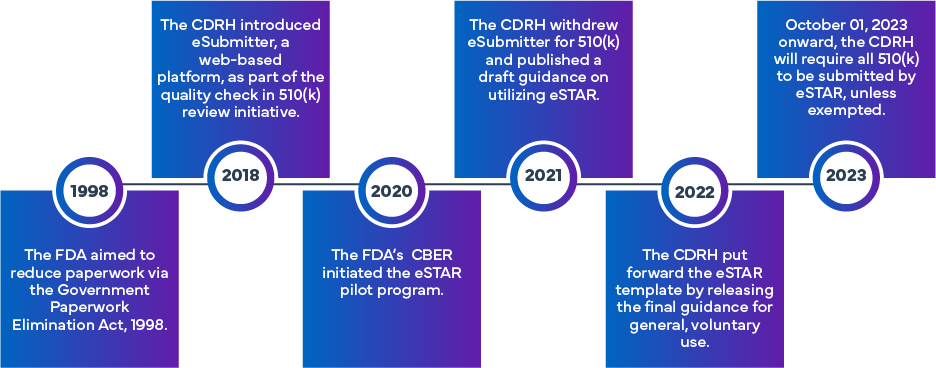
¿Qué es el eSTAR de FDA ?
El eSTAR es una plantilla PDF interactiva diseñada para facilitar la preparación de una solicitud completa Dispositivos Médicos para el proceso de autorización 510(k) FDAen los US Además, los solicitantes pueden utilizar el eSTAR para enviar respuestas a las solicitudes de información adicional FDA. Su objetivo es mejorar la calidad de las solicitudes de diversos dispositivos médicos, garantizando que los solicitantes proporcionen datos completos y de alta calidad para la revisión previa a la comercialización FDA.
Al adoptar el formato eSTAR, los solicitantes pueden estar seguros de la integridad de sus solicitudes, lo que, a su vez, permitirá FDA la FDA revisiones previas a la comercialización de manera más eficiente y garantizar el acceso oportuno a dispositivos médicos seguros y eficaces. La plantilla eSTAR está disponible de forma gratuita y puede ser utilizada voluntariamente por todos Dispositivos Médicos para las solicitudes 510(k), De Novo y Q a la FDA. Hay dos tipos de plantillas eSTAR: una para dispositivos médicos y otra para IVD. El 9 de junio de 2023, la FDA una versión beta de eSTAR (PreSTAR) para las presentaciones previas (un tipo de presentaciones Q).
Características y limitaciones de las presentaciones eSTAR
Aunque el programa eSTAR ofrece un formulario PDF interactivo diseñado para ayudar a los solicitantes a elaborar solicitudes completas Dispositivos Médicos IVD, tiene tanto ventajas como desventajas. Los solicitantes deben comprender estos beneficios y limitaciones, en función de los cuales pueden tomar decisiones bien informadas sobre la integración de eSTAR en su proceso de presentación. En la tabla siguiente, exploraremos las características y restricciones del programa eSTAR.

Consideraciones para un uso eficaz de eSTAR
Una característica ventajosa de la plantilla eSTAR, que contribuye a la optimización del proceso de presentación, es su incorporación automática de reglamentos pertinentes y normas reconocidas para su citación. Esto no sólo acelera el proceso de presentación al reducir la introducción manual de datos, sino que también mitiga la posibilidad de que se produzcan errores humanos durante la introducción de reglamentos y normas. Gracias a la construcción guiada de cada sección de presentación, la utilización de eSTAR en el proceso de presentación puede agilizarse sin esfuerzo.
- FDA sugiere Adobe Acrobat Pro o Foxit PDF Editor para editar las plantillas eSTAR.
- eSTAR incluye determinados formularios integrados, eliminando así la necesidad de cumplimentarlos por separado. Se trata del formulario 3514 (hoja de presentación) y del formulario 3881 (indicaciones de uso). Además, la declaración de veracidad y exactitud, que antes se exigía en el membrete de la empresa, ahora está integrada en eSTAR.
- eSTAR admite varios formatos de archivos adjuntos además de PDF, como hojas de cálculo de Excel y archivos de vídeo (mp4).
- No están permitidos los archivos en formato ejecutable o con macros.
- El tamaño total del archivo eSTAR PDF, junto con sus anexos, no debe superar 1 GB, ya que no se aceptarán archivos de más de 4 GB.
- Si sus archivos electrónicos superan los límites técnicos, puede enviar la presentación digital al Centro de Control de Documentos (DCC) del CDRH por correo.
Buenas prácticas para preparar las presentaciones eSTAR
Seguir algunas de las mejores prácticas para preparar las presentaciones eSTAR puede ayudar a los solicitantes a agilizar el proceso de presentación y mejorar sus posibilidades de obtener un resultado satisfactorio. He aquí algunas de ellas:
- Cumpla las directrices de FDA : La FDA ofrece orientación para ayudar a los solicitantes a utilizar con éxito la plantilla eSTAR. Seguir estas directrices garantiza que las presentaciones se ajusten a los requisitos y expectativas de FDA.
- Garantice la exhaustividad: La plantilla eSTAR orienta a los solicitantes sobre la información esencial que deben presentar. Los solicitantes deben proporcionar todos los datos requeridos para minimizar las posibilidades de deficiencias o solicitudes de información adicional.
- Mantener la coherencia: La plantilla eSTAR fomenta la uniformidad en el contenido y la estructura de las presentaciones 510(k). La estructura guiada para cada sección de la presentación ayuda a extraer información sobre los Dispositivos Médicos.
- Priorizar la claridad: Proporcione detalles claros y concisos en las presentaciones eSTAR para facilitar un proceso de revisión racionalizado. Estos detalles y precisión minimizan los retrasos y errores, y garantizan el acceso oportuno a las presentaciones previas a la comercialización de productos sanitarios.
- Precisión segura: La verificación automática de la información en cada sección de las presentaciones eSTAR ayuda a mitigar los retrasos en la revisión y las posibles deficiencias.
Importancia de la codificación por colores en la presentación eSTAR de FDA
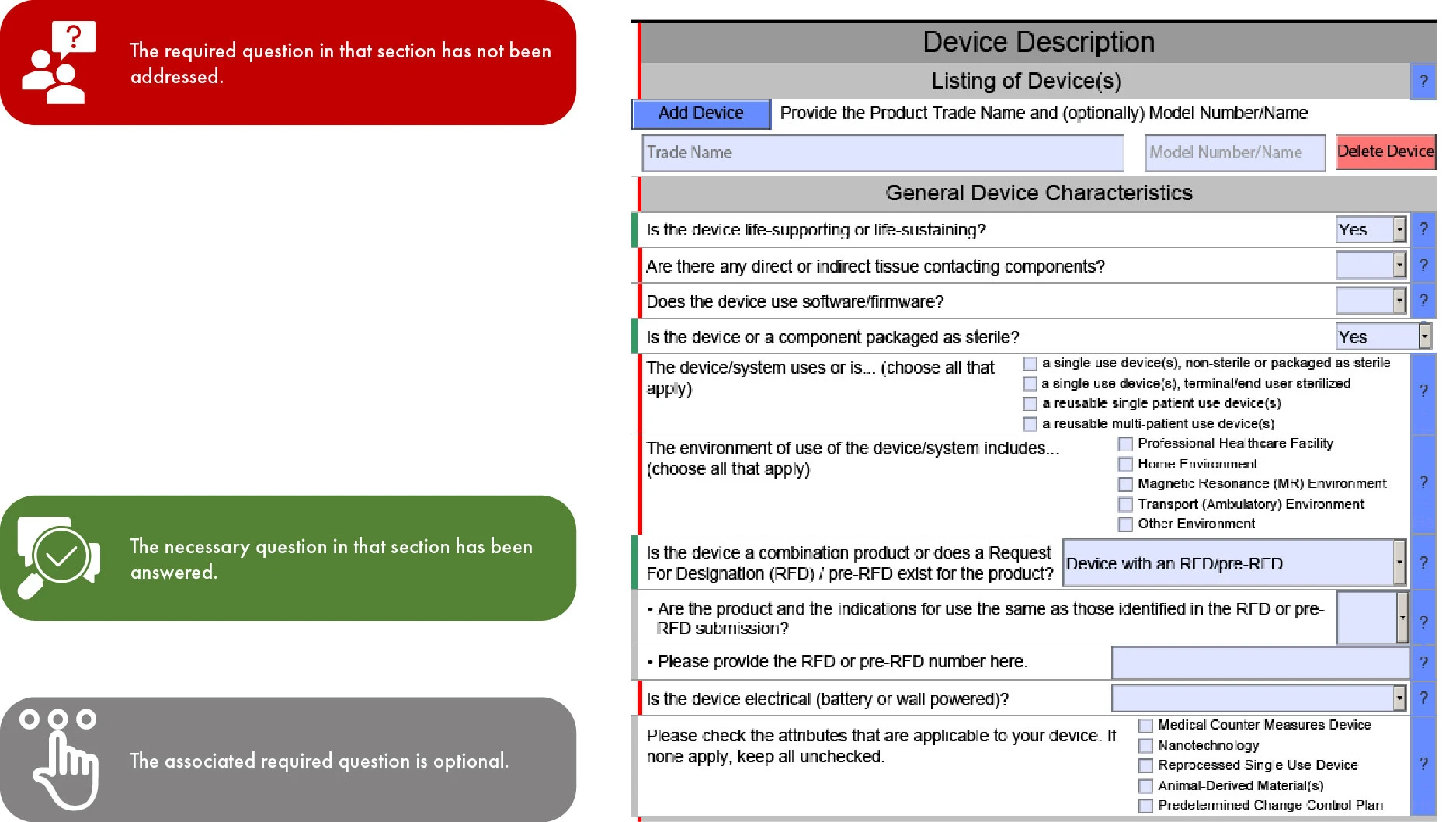
Dado que eSTAR será obligatorio para las presentaciones 510(k) a partir del 1 de octubre de 2023 y será voluntario para De Novo, la progresión de la plantilla a través de las secciones viene determinada por el tipo de presentación. Este tipo de racionalización facilita una revisión más rápida por parte deFDA US , lo que minimiza las inconsistencias y omisiones en su presentación. Sin embargo, es importante tener en cuenta que la FDA retrasar su revisión si faltan las traducciones al inglés de la documentación proporcionada.

Alinee sus archivos adjuntos
Examine la plantilla eSTAR de antemano para entender cómo se dividen los anexos y asegúrese de que sus documentos coinciden con las secciones de anexos. Este paso es crucial, sobre todo para las empresas con presentaciones anteriores de 510(k), ya que su enfoque actual de la organización de documentos puede requerir ajustes. También podría ser necesario extraer el contenido de los anexos.
- eSTAR exige anexos concisos, que difieren de las presentaciones tradicionales.
- Espere numerosos archivos adjuntos, potencialmente docenas de ellos.
- Los archivos adjuntos permiten incluir datos como hojas de cálculo de Excel, archivos de vídeo MP4, documentos de Word, archivos JPEG, etc.
- eSTAR quiere números de página para la información adjunta, pero no sugiere utilizar una lista de comprobación de rechazo para las directrices de FDA .
Plantillas: Las plantillas son accesibles en el enlace proporcionado: https:fda
El futuro de eSTAR
Se prevé que eSTAR se actualizará una vez que se hayan finalizado los documentos de orientación aplicables exhaustivos. Con estas actualizaciones, el fabricante podrá consultar las versiones más recientes publicadas por laFDA US
Health Canada (HC) ha introducido una iniciativa piloto para emplear eSTAR en los dispositivos de clase III y IV. Existe la conjetura de que otras naciones podrían emular el ejemplo de Canadá y hacer que la adopción de eSTAR sea discrecional, en particular dentro del consorcio IMDRF. Sin embargo, hay que señalar que no ha habido declaraciones explícitas en este sentido.
¿Por qué elegir Freyr?
Freyr cuenta con una amplia experiencia adquirida gracias a su participación en numerosos proyectos centrados en la presentación de solicitudes a FDA FDA en el pasado. Mediante la presentación de vías duales para ayudar proactivamente a la industria a acelerar las presentaciones 510(k) y De Novo, Freyr proporciona una serie de servicios al cliente, que abarcan una lista completa de los documentos de presentación esenciales y la información requerida, la realización de meticulosos análisis de deficiencias en la documentación, la compilación de presentaciones a través de eSTAR, y la finalización del paquete de presentación previa a la comercialización a FDA FDA. Además, Freyr amplía su apoyo a las actividades posteriores a la presentación, como el suministro de información adicional y la revisión de las respuestas de la industria a cualquier solicitud de información complementaria planteada por la FDA.
¿Cómo ayudará Freyr ?
Freyr ofrece apoyo que puede ser útil para prepararse para las presentaciones 510(k) y De Novo. Los servicios incluyen:
- Apoyo a la vía reglamentaria: Se trata de identificar el código del producto, el nombre y el número de la normativa, los posibles dispositivos de referencia, las pruebas de rendimiento, así como las normas aplicables y los documentos de orientación pertinentes para el dispositivo específico en cuestión.
- Apoyo en la presentación de Q (Presentaciones previas): Se trata de ayudarle a aclarar dudas relacionadas con los requisitos previos a la comercialización, organizar la presentación, prepararse para una reunión FDA , interactuar con la FDA durante la reunión y redactar el acta de la reunión.
La experiencia del programa eSTAR FDA
- Estrategia reguladora global FDA .
- Identificación del dispositivo de predicado.
- Establecer la equivalencia sustancial con el dispositivo predicado.
- Análisis de carencias para el cumplimiento de FDA .
- Recopilación de veintiuna (21) secciones del expediente técnico 510(k).
- Publicación y creación del eCopy.
- Validación y presentación del eCopy.
- Servicios de enlace para la aprobación de dispositivos.
- El tratamiento de la respuesta y las deficiencias de la RTA.
- Servicios de consulta para subsanar deficiencias.
- Listado de dispositivos y mantenimiento de la base de datos FURLS.