Preguntas frecuentes
Asuntos Regulatorios RA) en la industria farmacéutica implican garantizar la calidad, la seguridad y la eficacia de los medicamentos a lo largo de su ciclo de vida. RA se ocupan de los complejos requisitos de las autoridades sanitarias mundiales, manteniendo el cumplimiento desde el descubrimiento del fármaco hasta su comercialización. Actúan como enlace de comunicación entre las empresas farmacéuticas y las autoridades reguladoras de todo el mundo.
El principal objetivo de la regulación en la industria farmacéutica es salvaguardar la salud pública garantizando que los nuevos medicamentos sean seguros y eficaces antes de llegar al mercado. Los organismos reguladores aplican normas rigurosas de ensayo y evaluación que minimizan los posibles riesgos para la salud. Esta supervisión reguladora proporciona confianza en los tratamientos médicos a disposición del público.
Asuntos Regulatorios garantizan que los productos farmacéuticos cumplan con las normas reglamentarias a lo largo de todo su ciclo de vida. Participan en el diseño de ensayos clínicos, la autorización de comercialización y la gestión posterior a la aprobación, garantizando el cumplimiento continuo y facilitando los cambios necesarios en los productos. Su experiencia ayuda a las empresas a comercializar productos seguros y eficaces de manera eficiente.
La gestión del ciclo de vida de los productos farmacéuticos implica mantener la viabilidad de un producto desde su desarrollo hasta después de su aprobación. Incluye estrategias para el desarrollo clínico, la autorización de comercialización y el cumplimiento continuo de las normas reguladoras. Una gestión eficaz del ciclo de vida garantiza que el producto siga siendo seguro y eficaz durante toda su presencia en el mercado.
La regulación farmacéutica ha evolucionado significativamente, desde las listas de medicamentos medievales hasta los esfuerzos modernos de armonización internacional. Entre los hitos más importantes se encuentran la Ley de Alimentos y Medicamentos US de 1906 US y la creación de la Conferencia Internacional sobre Armonización (ICH) en 1990. Estos avances han reforzado las normas mundiales en materia de seguridad y eficacia de los medicamentos.
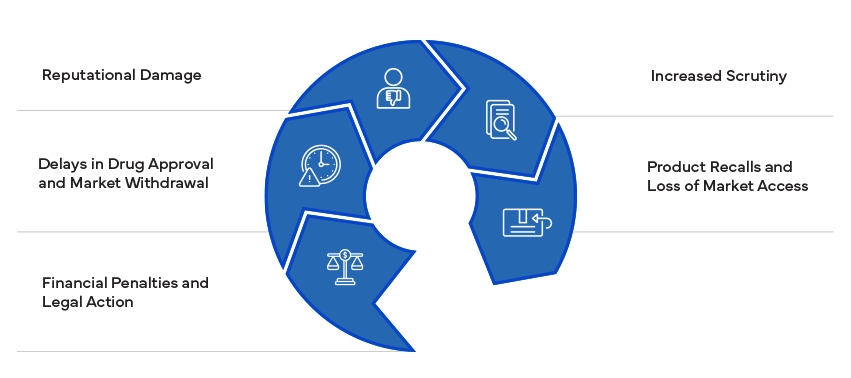
El incumplimiento de las normas reglamentarias puede acarrear importantes consecuencias, como multas, litigios y retirada de productos. Puede dañar la reputación de una empresa y dar lugar a un mayor escrutinio por parte de las autoridades reguladoras. Garantizar el cumplimiento es esencial para evitar estos riesgos y mantener el acceso al mercado.
Freyr ofrece soluciones integrales en materia de reglamentación, apoyando a sus clientes desde las primeras fases de desarrollo hasta la comercialización. Sus servicios incluyen la preparación de documentación para las autoridades sanitarias, la identificación de retos regulatorios y el asesoramiento sobre estrategias posteriores a la comercialización. La experiencia de Freyr ayuda a acelerar el desarrollo de productos y su comercialización.
La armonización reglamentaria mundial pretende agilizar los procesos de desarrollo y registro de medicamentos en los distintos países. Minimiza los ensayos con animales y garantiza la salud pública al alinear los requisitos normativos a escala internacional. Esta armonización facilita la introducción eficaz de nuevos tratamientos en los mercados mundiales.
Las agencias reguladoras, como FDA en Estados Unidos y EMA en la Unión Europea, aplican normas para garantizar la seguridad y eficacia de los medicamentos. Supervisan exhaustivos procesos de ensayo y evaluación antes de que los medicamentos puedan comercializarse. Estas agencias equilibran la necesidad de nuevos tratamientos con la minimización de los posibles riesgos para la salud.
El marco de Global Regulatory intelligence de Freyr proporciona información actualizada sobre la normativa global y la posición de las autoridades sanitarias. Este marco se integra en los proyectos de clientes para mejorar el éxito específico del mercado. Apoya la planificación estratégica y el cumplimiento normativo en múltiples geografías.