Regulatory Labeling Services globales Regulatory Labeling Services farmacéutico Regulatory Labeling Services
Aproveche una década de experiencia con nuestros Regulatory Labeling services, que abarcan las autorizaciones de nuevos productos, las presentaciones a las autoridades sanitarias, las aprobaciones posteriores, CMC y la gestión del ciclo de vida. Nuestro enfoque en la excelencia global y local garantiza la creación estratégica y las actualizaciones de documentos de etiquetado esenciales como IB, CDS y CCDS, garantizando el cumplimiento y el éxito en la industria farmacéutica.
Examinar temas
- ¿Qué es el etiquetado reglamentario?
- ¿Por qué es importante el etiquetado reglamentario en farmacia?
- ¿Qué es el proceso de aprobación del etiquetado?
- ¿Cuáles son los retos habituales del etiquetado reglamentario?
- ¿Cuáles son las principales normas que rigen el etiquetado farmacéutico?
- ¿Cómo puede ayudar un socio regulador a cumplir los requisitos de etiquetado?
- ¿Cómo pueden empezar las empresas con Regulatory Labeling Services?
- ¿Pueden Regulatory Labeling Services ayudar en el seguimiento posterior a la comercialización?
- ¿Por qué elegir Freyr?
- Nuestros servicios
¿Qué es el etiquetado reglamentario?
Última actualización agosto, 2024
El etiquetado farmacéutico reglamentario implica la creación, revisión y gestión de documentos críticos que comunican información esencial del producto a las partes interesadas, garantizando el cumplimiento de las normas reglamentarias mundiales. Entre los componentes básicos se encuentran la ficha de datos fundamentales (CDS) y la ficha de datos fundamentales de la empresaCCDS), derivadas de fuentes como los folletos de investigación y los datos posteriores a la comercialización. Este proceso es fundamental para transmitir información sobre seguridad y eficacia en las etiquetas específicas de cada país y cumplir los requisitos de Health Authority (HA) .
Con un enfoque en la armonización global, el etiquetado farmacéutico regulatorio aborda las cambiantes demandas regulatorias, abarcando nuevas autorizaciones de productos, presentaciones de HA, post-aprobaciones y gestión del ciclo de vida. La precisión y el cumplimiento de las directrices en evolución son cruciales para el éxito del etiquetado farmacéutico reglamentario, ya que influyen en la autorización de comercialización, el perfil de seguridad y la viabilidad reglamentaria general de un producto.

Freyr, líder en Regulatory labeling services end-to-end Regulatory labeling services end-to-end , cuenta con un equipo dedicado de más de 180 expertos en etiquetado a nivel mundial, que se destacan en la redacción de documentos cruciales, como folletos de investigación (IB), hojas de datos básicos de desarrollo e información básica de seguridad de desarrollo. El aprovechamiento de la inteligencia artificial mejora la precisión y agiliza la implementación y revisión de las hojas de datos. Con una CCDS optimizada y procesos basados en la precisión, los servicios integrales de Freyr satisfacen eficazmente las necesidades dinámicas de la industria farmacéutica, proporcionando un apoyo sin igual para el cumplimiento de la normativa de etiquetado y el éxito regulatorio.
¿Por qué es importante el etiquetado reglamentario en farmacia?
- Garantizar la seguridad del paciente y la comunicación de la información: El etiquetado reglamentario es crucial para la seguridad del paciente. Las etiquetas proporcionan información esencial sobre el uso, las dosis, los efectos secundarios y las contraindicaciones de los medicamentos. Los pacientes, los médicos prescriptores, los profesionales sanitarios y los cuidadores confían en estas etiquetas para tomar decisiones informadas. Un etiquetado claro y preciso reduce el riesgo de errores de medicación, efectos adversos y uso indebido.
Garantiza que los pacientes reciban el tratamiento correcto y comprendan su uso adecuado. Además, las autoridades reguladoras exigen que cada producto farmacéutico comercializado tenga un etiquetado que comunique eficazmente la información sobre el tratamiento. - Cumplimiento normativo y mitigación de riesgos: El cumplimiento de las normativas de etiquetado no es solo una formalidad, sino un requisito legal. Organismos reguladores como la Administración US y Medicamentos US (FDA), la Agencia Europea de Medicamentos (EMA) y otros exigen un etiquetado preciso y completo. El incumplimiento puede dar lugar a multas reglamentarias, daños a la reputación de la marca e incluso paradas temporales de la línea de producción. Las empresas farmacéuticas deben demostrar que sus procesos, métodos, pruebas y equipos de etiquetado son capaces de producir de forma sistemática productos seguros y eficaces. Un etiquetado debidamente validado mitiga los riesgos y garantiza el cumplimiento de las buenas prácticas de fabricación (BPF).
- Acceso al mercado y armonización mundial: Unas etiquetas bien estructuradas facilitan el acceso al mercado mundial. Un etiquetado coherente en todas las regiones agiliza los procesos, reduce las redundancias y se ajusta a las normas armonizadas. A medida que los organismos reguladores internacionales adoptan requisitos de validación de BPF, incluida la serialización, las cadenas de suministro farmacéuticas se enfrentan a una complejidad cada vez mayor. Las empresas que dan prioridad a la conformidad del etiquetado generan confianza, mejoran la aceptación en el mercado y se posicionan para el éxito en un entorno competitivo.
¿Qué es el proceso de aprobación del etiquetado?
El proceso de aprobación del etiquetado en la industria farmacéutica consta de varias etapas para garantizar que toda la información relacionada con el medicamento sea precisa, conforme y clara tanto para los profesionales sanitarios como para los pacientes. Comienza con la redacción del contenido de la etiqueta, que incluye detalles sobre dosis, administración, seguridad y advertencias. A continuación, los equipos reguladores y médicos revisan internamente este borrador para asegurarse de que se ajusta a las normas reguladoras locales e internacionales. Una vez finalizada, la etiqueta se presenta a las autoridades sanitarias para su aprobación, donde se somete a un riguroso escrutinio para verificar que cumple los requisitos de seguridad y eficacia. Sólo después de recibir la aprobación oficial puede utilizarse la etiqueta para comercializar el medicamento.
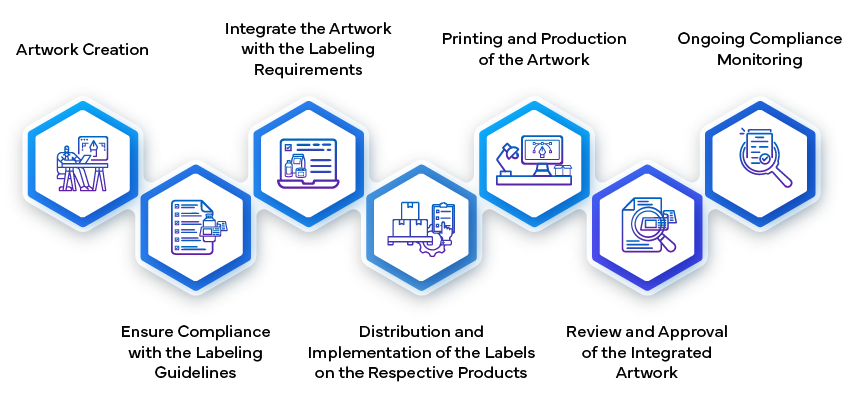
- Creación y envío de la etiqueta:
- Recopilación inicial de datos: Las empresas farmacéuticas recopilan todos los datos relevantes para la etiqueta del medicamento. Esto incluye información sobre eficacia, seguridad, dosis, indicaciones, contraindicaciones y riesgos potenciales. La etiqueta es una herramienta de comunicación fundamental para los profesionales sanitarios y los pacientes.
- Presentación ante las autoridades reguladoras: La empresa presenta los datos de la etiqueta a organismos reguladores, como la Administración US y Medicamentos US (FDA) o la Agencia Europea de Medicamentos (EMA). Estas agencias evalúan los datos para garantizar que el medicamento ofrece beneficios que superan sus riesgos conocidos y potenciales para la población destinataria.
- Análisis contextual: Los revisores analizan la afección o enfermedad a la que se destina el medicamento. Consideran el panorama terapéutico existente y sopesan los riesgos del medicamento frente a sus beneficios. Por ejemplo, un medicamento que trata una enfermedad potencialmente mortal sin alternativa terapéutica puede aprobarse aunque los riesgos fueran inaceptables para una enfermedad no mortal.
- Evaluación de datos clínicos: Los revisores de FDA evalúan la información sobre beneficios y riesgos clínicos presentada por el fabricante del medicamento. Tienen en cuenta cualquier incertidumbre derivada de datos imperfectos o incompletos. Normalmente, la agencia espera que los resultados de ensayos clínicos bien diseñados validen la eficacia y seguridad del medicamento.
- Establecimiento de la Artwork:
- Una vez aprobado el contenido de la etiqueta, el siguiente paso es crear el artwork de la misma. Esto implica diseñar los elementos visuales, la maquetación, las fuentes y los gráficos. El artwork ajustarse a las directrices reglamentarias y representar con precisión la información que figura en la etiqueta.
- artwork de la etiqueta artwork revisiones internas dentro de la empresa farmacéutica para garantizar su coherencia y conformidad. Incluye detalles como instrucciones de dosificación, advertencias, condiciones de almacenamiento e información de contacto.
- artwork final artwork envía a las autoridades reguladoras para su aprobación. Este paso garantiza que la presentación visual de la etiqueta cumpla con los estándares de calidad y comunique de manera eficaz la información esencial a los usuarios.
- Fabricación y aplicación:
- Una vez aprobado, el artwork de la etiqueta artwork parte integrante del envase del medicamento. Los fabricantes se aseguran de que las etiquetas se adhieran correctamente a cada unidad del producto (por ejemplo, frascos, blísteres, viales).
- Los procedimientos de control de calidad verifican que las etiquetas cumplan las especificaciones, incluido el contenido preciso, la legibilidad y el cumplimiento de las directrices de diseño.
- La etiqueta sirve de puente entre la empresa farmacéutica, los organismos reguladores, los profesionales sanitarios y los pacientes. Desempeña un papel fundamental a la hora de garantizar un uso seguro y eficaz del medicamento durante todo el ciclo de vida del producto.
¿Cuáles son los retos habituales del etiquetado reglamentario?
Entre los retos más comunes del etiquetado reglamentario se encuentran mantenerse al día de los cambiantes requisitos reglamentarios, gestionar el etiquetado multilingüe y garantizar la coherencia entre las diversas carteras de productos. La naturaleza dinámica de las normas reguladoras del etiquetado farmacéutico exige una vigilancia continua para mantenerse al día de los últimos requisitos. Adaptarse a los cambios de la normativa y aplicar rápidamente las actualizaciones necesarias del contenido y el formato del etiquetado es esencial para mantener la conformidad y garantizar la seguridad de los pacientes.
| Desafío | Descripción |
|---|---|
| Evolución de los requisitos reglamentarios | Enfrentarse a normativas y directrices en continuo cambio, que requieren actualizaciones constantes de la documentación de etiquetado. |
| Armonización mundial | Garantizar la coherencia de la información sobre los productos en las distintas regiones, en consonancia con los diversos requisitos de las distintas autoridades sanitarias. |
| Integración de datos postcomercialización | Gestionar la incorporación de datos de seguridad y eficacia posteriores a la comercialización en el etiquetado, manteniendo la precisión y la pertinencia. |
| Cumplimiento de las normas locales de etiquetado | Cumplir las normas de etiquetado específicas de cada país, teniendo en cuenta las variaciones lingüísticas, culturales y de formato. |
| Gestión eficaz del cambio de etiquetado | Racionalización de los procesos de seguimiento, aplicación y documentación de los cambios de etiquetado de forma rápida y precisa. |
El etiquetado multilingüe supone un reto importante para las empresas farmacéuticas que operan en mercados globales. Traducir con precisión el contenido del etiquetado a varios idiomas, respetando al mismo tiempo los matices lingüísticos y normativos regionales, requiere atención al detalle y procesos sólidos de gestión de la traducción. Garantizar la coherencia y la claridad en las diferentes versiones lingüísticas es crucial para comunicar eficazmente información vital a diversas poblaciones de pacientes.
Mantener la coherencia en todas las carteras de productos supone otro reto común en el etiquetado reglamentario. Las empresas farmacéuticas suelen gestionar varios productos con distintos requisitos de etiquetado, formulaciones e indicaciones. Lograr la coherencia y el cumplimiento de las diversas líneas de productos, al tiempo que se satisfacen las exigencias normativas específicas de cada producto, requiere procesos y sistemas eficientes que garanticen la uniformidad del contenido, el formato y los mensajes del etiquetado.
¿Cuáles son las principales normas que rigen el etiquetado farmacéutico?
El etiquetado farmacéutico se rige por un complejo conjunto de normas destinadas a garantizar la seguridad, la eficacia y el uso correcto de los medicamentos. A continuación se enumeran algunas de ellas:
Administración de Alimentos y Medicamentos de los Estados US FDA )
FDA US FDA el etiquetado de los productos farmacéuticos mediante un estricto conjunto de normas recogidas en el Título 21 del Código de Regulaciones Federales (CFR). Estas normas exigen que las etiquetas proporcionen información completa, incluyendo las indicaciones del medicamento, las instrucciones de uso, las contraindicaciones y los posibles efectos secundarios. La FDA la importancia de utilizar un lenguaje claro, preciso e inequívoco para garantizar la seguridad de los pacientes y la toma de decisiones informadas por parte de los profesionales sanitarios. Además, los requisitos de etiquetado FDA se extienden a diversos aspectos, como el embalaje, los prospectos y el etiquetado electrónico, lo que garantiza que toda la información sea accesible y esté estandarizada en los diferentes formatos. El cumplimiento de estas normas es obligatorio para la aprobación de los medicamentos y su permanencia en el mercado de los Estados Unidos.
EMA (Agencia Europea de Medicamentos)
EMA supervisa el etiquetado farmacéutico en la Unión Europea mediante directivas y directrices destinadas a armonizar el etiquetado en todos los member states. La Directiva 2001/83/CE de European Commission es fundamental para estos esfuerzos, ya que especifica los requisitos para el Resumen de las Características del Producto (SmPC), los prospectos de información al paciente y las etiquetas de los envases. EMA garantiza que el etiquetado incluya información esencial tanto para los profesionales sanitarios como para los pacientes, promoviendo un uso seguro y eficaz de los medicamentos en toda la EU (European Union). Además, el etiquetado debe estar disponible en las lenguas oficiales de los member states miembros en los que se comercializa el medicamento, lo que refleja el compromiso de la EMA con la accesibilidad y la atención centrada en el paciente.
TGA (Therapeutic Goods Administration)
En Australia, la TGA es responsable de regular el etiquetado farmacéutico en virtud de la Ley de Productos Terapéuticos de 1989. Las directrices de la TGA exigen que las etiquetas de los medicamentos proporcionen información clara, precisa y completa sobre el producto, incluidos sus ingredientes, indicaciones, dosificación y riesgos potenciales. Los requisitos de etiquetado tienen por objeto proteger la salud pública garantizando que los consumidores y los profesionales sanitarios dispongan de la información necesaria para utilizar los medicamentos de forma segura y eficaz. La TGA también hace especial hincapié en la legibilidad de las etiquetas, exigiendo que estén escritas en un inglés sencillo y que la información fundamental aparezca en un lugar destacado para evitar el uso indebido y los errores de medicación.
Health Canada
Health Canada regula el etiquetado de los productos farmacéuticos mediante un marco que da prioridad a la seguridad y el bienestar de los pacientes y los profesionales sanitarios. La Ley de Alimentos y Medicamentos y sus reglamentos asociados establecen los requisitos que deben cumplir las etiquetas de los medicamentos, que deben incluir información detallada sobre la composición, las indicaciones, las contraindicaciones y los posibles efectos secundarios del producto. Health Canada también exige que las etiquetas sean bilingües, es decir, que se presenten tanto en inglés como en francés, para adaptarse a la diversidad lingüística del país. Además, Health Canada actualiza periódicamente sus requisitos de etiquetado para reflejar las nuevas pruebas científicas y la evolución de las necesidades de salud pública, garantizando que el etiquetado siga siendo pertinente y eficaz para promover el uso seguro de los medicamentos.
PMDA (Agencia de Medicamentos y Productos Sanitarios)
La PMDA, la autoridad reguladora de Japón, supervisa el etiquetado de los productos farmacéuticos de acuerdo con la Ley de Asuntos Farmacéuticos y las directrices correspondientes. La PMDA exige que las etiquetas de los medicamentos proporcionen información completa, incluidas las indicaciones, las instrucciones de dosificación y los posibles efectos adversos, en un formato fácilmente comprensible tanto para los profesionales sanitarios como para los pacientes. La PMDA también exige que las etiquetas incluyan advertencias y precauciones específicas para la población japonesa, teniendo en cuenta factores como las diferencias genéticas y las prácticas culturales. Este enfoque garantiza que los medicamentos se utilicen de forma segura y eficaz en Japón, con un etiquetado adaptado a las necesidades únicas del mercado local.
NMPA (Administración Nacional de Productos Médicos)
En China, la NMPA rige el etiquetado farmacéutico a través de un marco normativo que hace hincapié en la precisión, la claridad y la seguridad. La Ley de Administración de Medicamentos de la República Popular China establece los requisitos para las etiquetas de los medicamentos, que deben incluir información sobre las indicaciones, dosis, contraindicaciones y posibles efectos secundarios del medicamento. La NMPA también exige que el etiquetado se presente en chino simplificado para garantizar la accesibilidad de la población local. Además, la NMPA exige que las etiquetas se sometan a una revisión rigurosa durante el proceso de aprobación de los medicamentos para garantizar el cumplimiento de las normas nacionales y proteger la salud pública evitando errores de medicación y usos indebidos.
¿Cómo puede ayudar un socio regulador a cumplir los requisitos de etiquetado?
Un socio regulador es fundamental para lograr el cumplimiento de los requisitos de etiquetado, ya que ofrece conocimientos especializados y un apoyo integral. Guían a las empresas a través del complejo panorama normativo, garantizando que los materiales de etiquetado, incluidos los envases, los prospectos y las etiquetas electrónicas, cumplan los requisitos específicos de las diferentes autoridades sanitarias, como laFDA US , EMA, la TGA, Health Canada, PMDA y NMPA. Esto implica comprender y aplicar las últimas normativas, que pueden variar significativamente de una región a otra, para garantizar que toda la información del producto sea precisa, completa y conforme.
Además, un socio regulador ayuda a agilizar el proceso de etiquetado prestando servicios fundamentales como la creación, revisión y validación de contenidos. Ayudan a redactar y revisar el contenido del etiquetado para ajustarlo a las normas reglamentarias y garantizar que se incluya toda la información necesaria, desde listas de ingredientes e instrucciones de uso hasta advertencias de seguridad y condiciones de almacenamiento. Esto reduce el riesgo de errores y omisiones que podrían dar lugar a retrasos reglamentarios o retiradas del mercado, lo que acelera la comercialización de nuevos productos.

Además, un socio de Reglamentación ayuda a las empresas a mantener el cumplimiento en curso mediante el seguimiento de las actualizaciones de la Reglamentación y la aplicación de los cambios necesarios. Ofrecen asesoramiento estratégico para adaptar las etiquetas a las nuevas directrices o a los requisitos de los mercados emergentes, ayudando a las empresas a evitar problemas de incumplimiento y garantizando que sus productos sigan cumpliendo la normativa vigente. Aprovechando su experiencia y manteniéndose al día de los cambios normativos, un socio regulador ayuda a las empresas a navegar por el dinámico panorama del etiquetado con eficiencia y eficacia.
¿Cómo pueden empezar las empresas con Regulatory Labeling Services?
Para empezar con Regulatory labeling servicesario, las empresas deben evaluar primero sus necesidades específicas de etiquetado en función de los mercados de destino y los requisitos reglamentarios. A continuación, deben asociarse con un proveedor de servicios normativos fiable con experiencia en normas mundiales de etiquetado. Este proveedor puede ayudar a redactar, revisar y actualizar las etiquetas para garantizar su cumplimiento. Además, la implantación de un sistema centralizado de gestión del etiquetado ayuda a agilizar el proceso, garantizando la coherencia en todas las etiquetas de los productos. Las auditorías y actualizaciones periódicas son esenciales para mantener las etiquetas en consonancia con la evolución de la normativa.
Evaluar las necesidades normativas:
- Identifique los requisitos normativos específicos aplicables a su producto y mercados objetivo.
- Comprender los documentos fundamentales, como las fichas de datos fundamentalesCDS), los folletos de investigaciónIB) y los requisitos locales de etiquetado.
Seleccione un socio de etiquetado reglamentario:
- Investigue y elija un proveedor de servicios de etiquetado reglamentario con experiencia en su sector.
- Tenga en cuenta factores como la experiencia, el conocimiento de la normativa mundial y la capacidad para afrontar diversos retos de etiquetado.
Definir el alcance del proyecto:
- Describa claramente el alcance de su proyecto de etiquetado reglamentario, incluido el tipo de servicios requeridos (por ejemplo, redacción de IB , creación de CCDS , revisión de la conformidad del etiquetado).
- Establezca plazos, hitos y resultados para cada fase del proyecto.
Colaborar en la recogida de datos:
- Colabore estrechamente con su socio de etiquetado regulador elegido para recopilar datos esenciales, incluida información sobre ensayos clínicos, datos de seguridad y eficacia, y cualquier dato de vigilancia posterior a la comercialización.
Iniciar la creación y revisión de documentos:
- Comenzar la creación o revisión de documentos cruciales como IB, DCDS, CCDS y contenido de etiquetado local.
- Facilitar revisiones periódicas y sesiones de feedback para garantizar la precisión y la adecuación a los requisitos normativos.
Implantar procesos de control de cambios:
- Desarrollar procesos sólidos de control de cambios para etiquetar las actualizaciones y hacer un seguimiento rápido de cualquier modificación de los documentos básicos.
- Garantizar que los cambios se aplican de forma coherente en todas las marcas mundiales y regionales.
Controlar el cumplimiento:
- Establecer mecanismos de control permanente del cumplimiento de las normas reglamentarias en evolución.
- Manténgase informado sobre los cambios en la normativa y actualice los documentos de etiquetado en consecuencia.
Utilizar la tecnología y la automatización:
- Aproveche el software y la tecnología de etiquetado reglamentario para mejorar la precisión, la eficacia y la gestión de documentos.
- Explore herramientas compatibles con la inteligencia artificial para agilizar los procesos de implantación y revisión de hojas de datos.
Recurra a expertos en regulación:
- Recurra a expertos o consultores en normativa de su organización o a través del proveedor de servicios que haya elegido para que le proporcionen información y orientación a lo largo del proceso de etiquetado.
Mejora continua:
- Establecer una cultura de mejora continua, revisando y perfeccionando periódicamente los procesos de etiquetado en función de la información recibida, los cambios del sector y la evolución de la normativa.
¿Pueden Regulatory Labeling Services ayudar en el seguimiento posterior a la comercialización?
Sí, Regulatory labeling services pueden ayudar en la vigilancia posterior a la comercialización de productos farmacéuticos. Estos servicios desempeñan un papel crucial en el apoyo a la vigilancia posterior a la comercialización, facilitando la gestión de las actualizaciones del etiquetado, gestionando los cambios de etiquetado relacionados con la seguridad y garantizando el cumplimiento de los requisitos reglamentarios posteriores a la aprobación. Al mantener la información de etiquetado precisa y actualizada, los Regulatory labeling services tiquetado Regulatory labeling services ayudan a las empresas farmacéuticas a responder a los problemas de seguridad y a aplicar a tiempo los cambios necesarios para apoyar el cumplimiento reglamentario continuo y la seguridad de los pacientes.
Además, Regulatory labeling services pueden contribuir a la difusión eficaz de información de seguridad actualizada a los profesionales sanitarios y los pacientes. En caso de nuevos hallazgos de seguridad o cambios en los perfiles de riesgo de los productos farmacéuticos, los expertos en etiquetado reglamentario pueden ayudar a actualizar rápidamente el contenido del etiquetado para reflejar los datos de seguridad y los requisitos reglamentarios más recientes. Este enfoque proactivo de la supervisión posterior a la comercialización y las actualizaciones del etiquetado favorece la comunicación puntual de información importante sobre seguridad a los profesionales sanitarios y los pacientes, lo que contribuye a mejorar la farmacovigilancia y la atención al paciente.
En general, Regulatory labeling services proporcionan un valioso apoyo en la supervisión posterior a la comercialización, garantizando que los productos farmacéuticos mantengan un etiquetado preciso y conforme durante todo su ciclo de vida. Aprovechando la experiencia de los profesionales de la reglamentación y los procesos eficientes de gestión del etiquetado, las empresas pueden abordar eficazmente las consideraciones de seguridad posteriores a la comercialización y las obligaciones reglamentarias, contribuyendo así a la seguridad y eficacia continuas de sus productos en el mercado.
¿Por qué elegir Freyr?
Una década de excelencia en etiquetado reglamentario
Más de 180 expertos mundiales en servicios de etiquetado
Especializado en la creación y gestión de documentos esenciales
Experiencia en folletos de investigación, fichas de datos básicos y fichas de datos básicos de empresas
Comprometidos con el cumplimiento y la precisión a escala mundial
Utiliza AI (Artificial Intelligence) ) para una navegación eficaz por la normativa
Datos breves
+
+
+
Preguntas frecuentes
Las Fichas de Datos Fundamentales (CDS) proporcionan un resumen consolidado de información fundamental sobre medicamentos, como indicaciones, dosis y perfiles de seguridad. Garantizan una comunicación coherente de los detalles esenciales en todos los mercados mundiales, facilitando el cumplimiento de la normativa y la toma de decisiones informadas. Las CDS también sirven de referencia para crear etiquetas locales de los productos.
Los folletos de investigación (IB) detallan los datos de los ensayos clínicos y la información sobre el desarrollo de fármacos para uso en investigación, mientras que las hojas de datos básicos de la empresa (CCDS) resumen los datos clave sobre seguridad y eficacia con fines reglamentarios a nivel mundial, orientando el contenido y las actualizaciones de las etiquetas. CCDS utilizan para crear etiquetas específicas de cada producto para su aprobación en el mercado.
La inteligencia artificial mejora el etiquetado reglamentario mediante la automatización del análisis de datos, la mejora de la precisión en la creación de contenidos y la agilización de las revisiones de documentos. Las herramientas de IA agilizan los procesos de etiquetado y garantizan la coherencia entre los distintos requisitos normativos. También ayudan a predecir y abordar posibles problemas de cumplimiento.
El etiquetado multilingüe garantiza que los productos farmacéuticos sean accesibles a diversas poblaciones de pacientes, cumpliendo los requisitos normativos regionales y mejorando la seguridad al proporcionar instrucciones y advertencias claras y comprensibles en varios idiomas. Esto reduce el riesgo de falta de comunicación y de errores en la administración de medicamentos.
Un sistema centralizado de gestión del etiquetado coordina la creación, revisión y actualización de los documentos de etiquetado, garantizando la coherencia y el cumplimiento en todos los mercados mundiales. Agiliza los procesos y mantiene información precisa y actualizada sobre los productos. Este sistema también permite gestionar eficazmente los cambios en el etiquetado y las actualizaciones normativas.
Structured Product Labeling (SPL) ) es un formato XML utilizado para el etiquetado de medicamentos que normaliza y organiza la información sobre los productos. Garantiza la coherencia y facilita el intercambio de datos entre los organismos reguladores y los fabricantes. El SPL facilita la gestión eficaz de la información de etiquetado a lo largo del ciclo de vida de un producto.
El Global Location Number (GLN) es un identificador único utilizado para identificar ubicaciones y entidades dentro de la cadena de suministro. Ayuda a rastrear y gestionar con precisión los productos farmacéuticos en los mercados mundiales. Los GLN garantizan una distribución de productos y una gestión de inventarios precisas y eficientes.
El Código Nacional de Medicamentos (NDC) es un identificador único de medicamentos, asignado por FDA. Ayuda a identificar con precisión los medicamentos y facilita la gestión y el seguimiento del inventario. El NDC es crucial para la dispensación precisa de medicamentos y la presentación de informes reglamentarios.
Un Manual del Investigador (IB) proporciona información detallada sobre los datos clínicos y preclínicos de un medicamento en investigación. Se utiliza para informar a los investigadores de ensayos clínicos sobre la seguridad, eficacia y dosificación del medicamento para fines de estudio. El IB también apoya la toma de decisiones éticas e informadas en la investigación clínica.












