BIMO son las siglas de Bioresearch Monitoring (Supervisión de la investigación biológica), un programa de inspección in situ y auditorías de datos para supervisar todos los aspectos de la realización y la presentación de informes de las investigaciones reguladas por la Administración US y Medicamentos US (FDA). El programa se creó en 1977 tras identificarse la necesidad de auditar los centros de investigación clínica. El objetivo principal de este programa es garantizar la calidad y la integridad de los datos presentados para la aprobación de nuevos productos y las solicitudes de comercialización. Además, este programa también protege los derechos y el bienestar de los sujetos humanos y animales que participan en las investigaciones FDA.
Objetivos clave del Programa BIMO
Anualmente se realizan más de 1000 inspecciones. Los principales objetivos cubiertos por el programa BIMO son:
- Auditoría de datos clínicos
- Inspección de la investigación clínica en curso
- Inspección de laboratorios no clínicos
- Inspección de las Juntas de Revisión Institucional (IRB)
¿Qué productos entran en el ámbito de BIMO Audit?
El BIMO es aplicable a medicamentos, productos biológicos, dispositivos médicos, productos alimenticios, productos del tabaco y productos veterinarios. El programa de cumplimiento está supervisado por los seis (06) centros de productos de FDAFDA: el Centro de Evaluación e Investigación de Productos Biológicos (CBER), el Centro de Dispositivos y Salud Radiológica (CDRH), el Centro de Evaluación e Investigación de Medicamentos (CDER), el Centro de Seguridad Alimentaria y Nutrición Aplicada (CFSAN), el Centro de Productos del Tabaco (CTP) y el Centro de Medicina Veterinaria (CVM).
¿Qué empresas se someten a la auditoría BIMO?
Tanto las empresas nacionales como las internacionales que lleven a cabo cualquiera de las actividades que se indican a continuación, o que estén incluidas en alguna de ellas, están sujetas a los requisitos del Control de la bioinvestigación.
- Laboratorios de ensayos no clínicos para el cumplimiento de las Buenas Prácticas de Laboratorio (GLP)
- Investigadores clínicos para el cumplimiento de las Buenas Prácticas Clínicas (BPC)
- Patrocinadores
- Organizaciones de Investigación por Contrato (CRO)
- Monitores de ensayos clínicos
- Instalaciones de bioequivalencia in vivo
- Juntas de revisión institucional (IRB)
¿Qué programas de cumplimiento entran en el Programa BIMO?
FDA US FDA realizar una auditoría BIMO en cualquier momento a través de los siete (07) programas de cumplimiento multicéntricos. Estos siete programas de cumplimiento multicéntricos se implementan a través de:
- Inspección del investigador clínico (IC) y del investigador patrocinador (IS)
- Inspección de la Junta de Revisión Institucional (IRB)
- Inspección de organizaciones de investigación por contrato/patrocinadores/monitoresCRO)
- Inspección de Buenas Prácticas de Laboratorio (GLP)
- Inspección de bioequivalencia y biodisponibilidad (BEQ)
- Inspección de los informes sobre experiencias adversas posteriores a la comercialización de medicamentos (PADE)
- Inspección de los informes de Evaluación de Riesgos, Mitigación y Estrategia (REMS)
Cada uno de estos programas describe detalladamente el alcance de la revisión o inspección que debe realizarse para garantizar el cumplimiento de la FDA.
¿Qué normativa se aplica a la auditoría BIMO?
Los reglamentos - 21 CFR 50 - Protección de Sujetos Humanos, 21 CFR 54-Divulgación Financiera, 21 CFR 56-IRBs, 21 CFR 58-Buenas Prácticas de Laboratorio para laboratorios no clínicos, 21 CFR 809-Productos de Diagnóstico In Vitro, y 21 CFR 812-Exención de Dispositivos de Investigación son aplicables para la Auditoría BIMO.
¿Cuántas auditorías se realizan anualmente en el marco del Programa BIMO?
El número de auditorías BIMO realizadas por laFDA US FDA cada año. En los últimos años, el número de inspecciones in situ ha disminuido debido al inicio de la pandemia de COVID-19, y la FDA que suspender toda la supervisión in situ de los estudios clínicos. Solo se supervisaban estudios clínicos específicos críticos y cruciales.
Las "evaluaciones reglamentarias a distancia" (RRA) se introdujeron durante la pandemia de COVID-19 para supervisar a distancia la investigación reglamentada. Las RRA se realizan a través de videoconferencias y son una iniciativa voluntaria para evaluar a distancia los datos y los procesos. No obstante, hay que señalar que las RRA no son equivalentes ni una alternativa a la inspección in situ, sino que se trata simplemente de un procedimiento que evolucionó debido a la pandemia COVID-19.
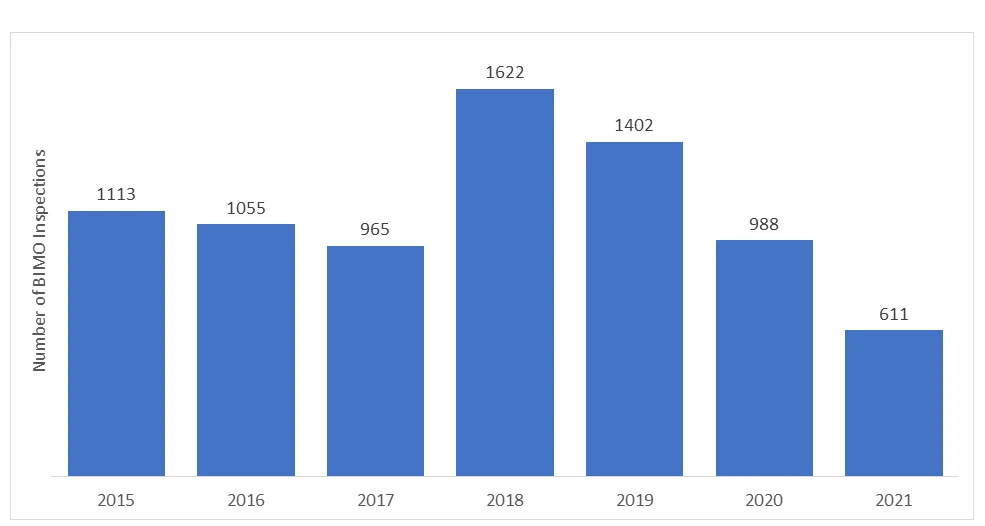
*Los datos representados para los años 2020 y 2021 no incluyen las inspecciones RRA
¿Cuántas evaluaciones reglamentarias a distancia (RRA) se llevaron a cabo durante la pandemia COVID-19 en el marco del Programa BIMO?
En 2021, la adopción de la inspección RRA aumentó significativamente en todos los programas. En abril de 2021, la FDApublicó un documento de orientación sobre "Remote Interactive Evaluations of Drug Manufacturing and Bioresearch Monitoring Facilities During the COVID-19 Public Health Emergency Guidance for Industry", que proporciona información exhaustiva sobre el proceso de la FDA para llevar a cabo las RRA.
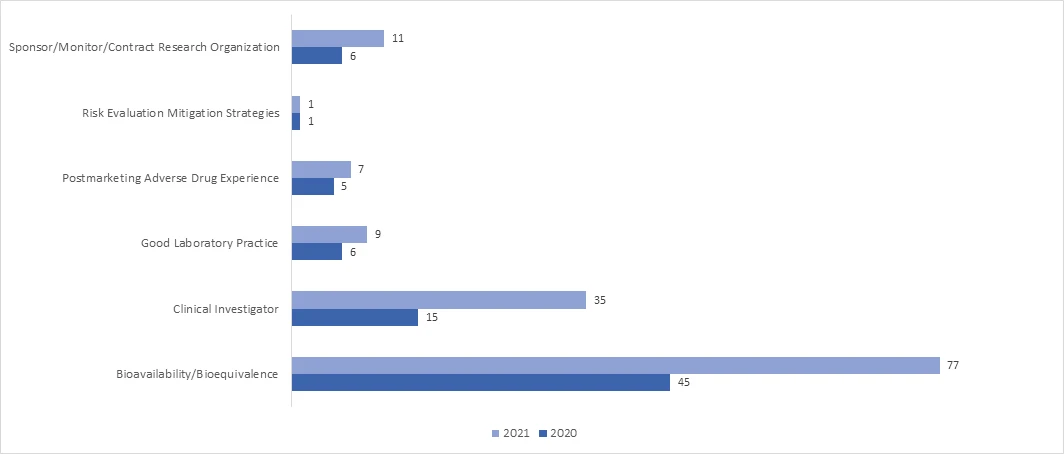
¿Cuáles son los posibles resultados de una auditoría BIMO?
Durante la auditoría de BIMO, laFDA US FDA decidir tomar cualquiera de las medidas que se enumeran a continuación en función del cumplimiento:
1. Ninguna acción indicada (NAI)
La NAI es aplicable cuando el inspector de campo FDA FDA no ha detectado ninguna práctica objetable o sólo problemas menores para los que no se justifica la adopción de nuevas medidas.
2. Acción voluntaria indicada (VAI)
El VAI es aplicable cuando se han identificado prácticas censurables pero no son significativas.
3. Acción oficial indicada (OAI)
La OAI es aplicable cuando se identifican prácticas objetables que comprometen la integridad de los datos y/o los derechos de los sujetos humanos.
¿Cuáles son las no conformidades más comunes emitidas en el marco de la auditoría BIMO?
Algunas de las no conformidades más comunes observadas durante la auditoría BIMO son las siguientes
- No llevar un control adecuado de los registros
- Incumplimiento del plan de investigación
- Incumplimiento de la normativa
- Fallos en el seguimiento de los protocolos
- Protección inadecuada de los sujetos
- Responsabilidad inadecuada del producto investigado
La auditoría BIMO es fundamental para cualquier desarrollador o fabricante de dispositivos y tecnologías médicas novedosas que tenga previsto lanzar su dispositivo al US . Es muy importante cumplir con las normativas y directrices para evitar cualquiera de los escollos descritos.
¿Necesita ayuda con respecto a las inspecciones de auditoría de BIMO? Póngase Reach contacto con Freyr. Manténgase informado. Cumpla las normas.