Dispositivos Médicos (MDR) es una herramienta de vigilancia posterior a la comercialización que utiliza la Administración de Alimentos y Medicamentos (FDA) para supervisar el rendimiento de los dispositivos, detectar posibles problemas de seguridad relacionados con ellos y contribuir a la evaluación de los riesgos y beneficios de los dispositivos. El objetivo de MDR es detectar y abordar de manera oportuna los eventos adversos relacionados con los dispositivos. Permite a los médicos, centros sanitarios, fabricantes y consumidores realizar notificaciones voluntarias para comprender la seguridad y eficacia de los dispositivos después de su comercialización.
El MDR es aplicable a todas las clases de productos sanitarios, ya sean fabricados en los Estados Unidos de América (EE. UU.) o importados a los EE. UU. Dispositivos Médicos que deseen comercializar sus productos en los EE. UU. deben cumplir con el MDR, de lo contrario, podrían incurrir en sanciones económicas. Es aplicable en los EE. UU., incluidos los casos extranjeros, es decir, es aplicable a los productos sanitarios comercializados legalmente en los Estados Unidos, tanto los fabricados en los EE. UU. como en países extranjeros. Además, existen varios casos de aplicabilidad del MDR, tales como:
- si un aparato se fabrica en EE.UU., se distribuye localmente y a otros mercados
- cuando un aparato se fabrica en EE.UU. pero se distribuye en otros mercados
- cuando un aparato se fabrica en el extranjero y se suministra en EE.UU. y otros mercados
- cuando un aparato se fabrica en el país extranjero y se distribuye localmente y
- cuando se investiga un dispositivo en EE.UU.
MDR y el flujo del proceso de notificación
El reglamento MDR contiene muchos requisitos obligatorios para que los fabricantes, importadores e instalaciones de usuarios de productos notifiquen a FDA FDA determinados acontecimientos adversos relacionados con productos y problemas de productos. El siguiente diagrama de flujo detalla el proceso de notificación paso a paso.
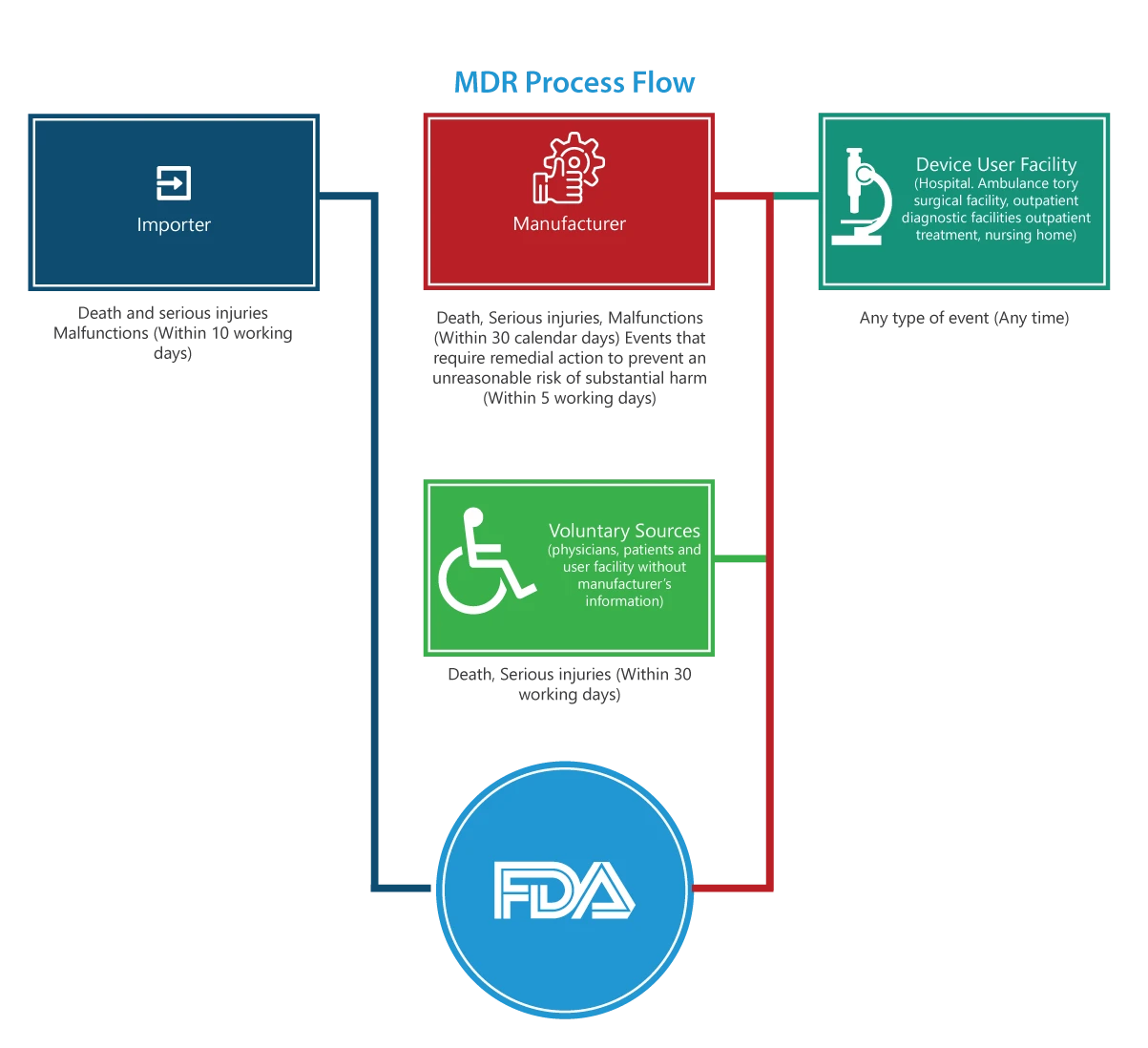
¿A quién se aplica?
Importadores
Los informes sobre muertes, lesiones graves y fallos de funcionamiento deben presentarse a FDA y al fabricante en un plazo de 30 días laborables. Si el mal funcionamiento puede causar lesiones o muertes en otro lugar, los importadores deben informar del mal funcionamiento al fabricante.
Fabricantes
Los informes relativos a un suceso (muertes, lesiones graves y fallos de funcionamiento) designado por FDA o un suceso que requiera medidas correctoras para evitar un riesgo irrazonable de daño sustancial para la salud pública deben presentarse a FDA FDA en un plazo de 5 días laborables cumplimentando el formulario 3500A.
Centro usuario del dispositivo (hospital, centro quirúrgico ambulatorio, residencia de ancianos, centro de diagnóstico ambulatorio o centro de tratamiento ambulatorio)
Los informes deben presentarse al fabricante del producto a más tardar 10 días laborables después del día en que se tenga conocimiento de que un producto ha causado o puede haber causado o contribuido a causar una lesión grave a un paciente del centro. Si se desconoce el fabricante, el centro debe presentar el informe a la FDA.
Grupos de voluntarios
Los pacientes, profesionales sanitarios y consumidores que detecten un problema relacionado con un Dispositivos Médicos informar a FDA MedWatch.
eMDR
La FDA ordenó el MDR electrónico (eMDR) en 2015 para identificar problemas críticos de calidad e integridad de los datos asociados con la notificación de lesiones graves relacionadas con todas las clases de productos sanitarios. Se prefiere que el eMDR sea el modo de notificación.
Los fabricantes pueden presentar sus eMDR a través de una pasarela electrónica de presentación de solicitudesESG). Desde el momento de la presentación, la pasarela electrónica tarda hasta 48 horas en enviar un acuse de recibo. Si se produce algún error al enviar el informe, aparecerá un mensaje para que se realicen las correcciones oportunas.
eMDR - ¿Qué beneficios aporta?
eMDR ofrece múltiples ventajas sobre el mecanismo de notificación manual (es decir, MDR). A continuación se enumeran algunas ventajas notables que pueden aprovechar los fabricantes, las agencias y los pacientes:
- La herramienta de presentación eMDR mejora la colaboración entre una organización, la agencia sanitariaFDA y los pacientes.
- eMDR ahorra costes. La automatización reduce la necesidad de gastos administrativos generales y de comunicación tradicional; ayuda a acelerar el proceso y fomenta la notificación eficaz de sucesos, lo que se traduce en una interacción inmediata con la FDA.
- Los procesos manuales implican mucho papeleo, pueden ser largos y difíciles de seguir y procesar. La presentación de eMDR está automatizada y centralizada. Los registros pueden recuperarse fácilmente, lo que ahorra mucho tiempo de revisión.
- eMDR permite a las partes señalar rápidamente los errores de presentación, en lugar de mantener una correspondencia manual con FDA FDA que lleva mucho tiempo.
- eMDR actúa como punto único de entrada para procesar todas las presentaciones electrónicas en un entorno de alta seguridad y es beneficioso porque las quejas en la organización pueden vincularse directamente al formulario MedWatch e integrarse en la pasarela de FDAFDA.
eMDR y el flujo del proceso de notificación
El reglamento eMDR contiene requisitos obligatorios para que los fabricantes, importadores e instalaciones usuarias de dispositivos notifiquen a FDA FDA determinados acontecimientos adversos relacionados con dispositivos y problemas de productos. El siguiente diagrama de flujo detalla paso a paso el proceso de notificación.
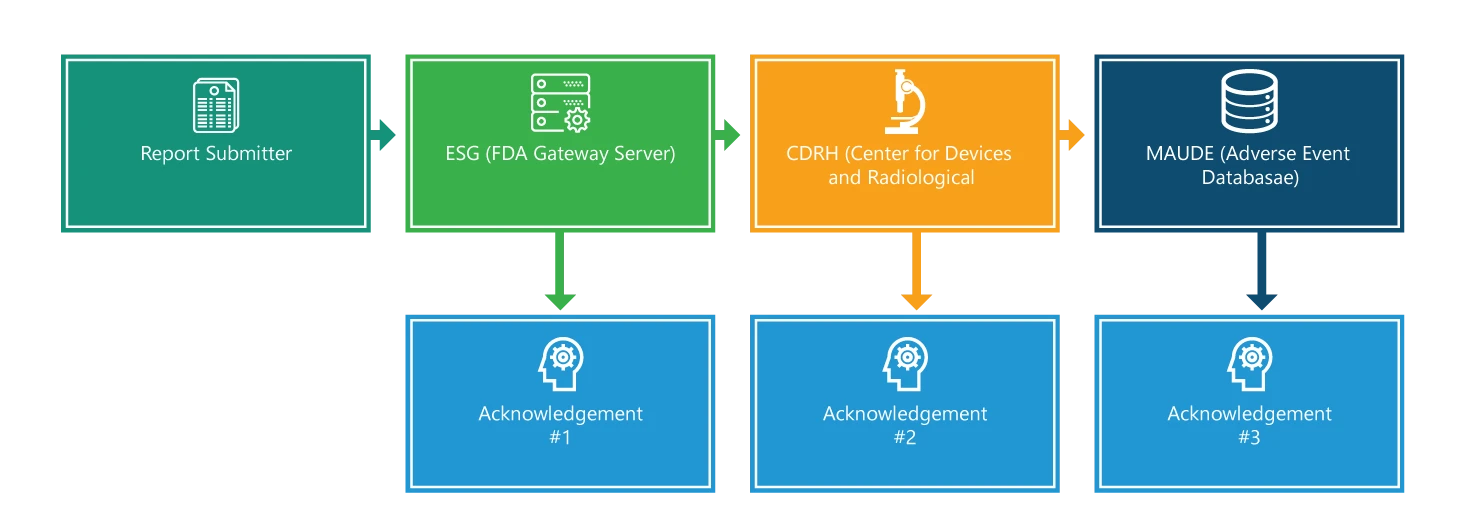
El proceso de información consta de cuatro pasos. Excepto en el primer paso, cada uno de ellos se reconoce. Además, en cada paso se proporciona información adicional que facilitará el proceso.
Paso 1: Envío de informes
Presentación de un eMDR. Al principio, para hacer una presentación, uno debe tener una firma electrónica y debe asegurarse de que los nombres de los archivos de presentación incluyan sólo un punto, que se utiliza para indicar la extensión del tipo de archivo (por ejemplo 555xml o 555.pdf). Sin embargo, el tiempo de entrega y tramitación de la solicitud depende del tamaño total de su presentación; las presentaciones más grandes tardan más tiempo en entregarse y tramitarse.
Paso 2: Portal de presentaciones electrónicasESG)
Cuando su envío llegue al ESG, debería recibir rápidamente un acuse de recibo nº 1, a menos que el ESG esté fuera de servicio por mantenimiento. Debe comprobar el estado de su MDR en el sitio web ESG ESG.
Paso 3: CRDH
El eMDR se envía automáticamente desde el ESG al Centro de Dispositivos y Salud Radiológica (CDRH). Una vez enrutado, como en el paso 2, debería recibir un acuse de recibo, es decir, #2.
Paso 4: Experiencia del fabricante y del usuario del dispositivo (MAUDE)
Cuando el CDRH valida y actualiza el envío en la base de datos de Eventos Adversos (MAUDE), se espera que el remitente reciba un acuse de recibo #3. Cabe señalar que se registra cualquier error que se produzca durante la validación y la carga.
Dispositivos Médicos (MDR) es un proceso fundamental que ayuda a salvar vidas y a proteger a los pacientes de riesgos innecesarios. Garantiza que todas las partes implicadas en la atención al paciente sean responsables y estén alerta en el uso de los dispositivos.
La eMDR facilita la elaboración de informes, pero la documentación y el seguimiento pueden consumir muchos recursos. Hágalo bien a la primera: hable con us en sales@freyrsolutions.com.