Ninsho (Dispositivos Médicos ) es un sistema de certificación de terceros en Japón en el que un organismo de certificación registrado (RCB), acreditado por el Ministro de Salud, Trabajo y Bienestar (MHLW), certifica los dispositivos médicos designados como altamente controlados. Es aplicable a los dispositivos de clase II y a un número limitado de dispositivos de clase III que tienen una norma industrial japonesa (JIS) asociada. Algunos dispositivos médicos de clase II sin criterios de certificación establecidos requieren la aprobación del programa Shonin.
¿Cuáles son las otras vías de registro de productos en Japón?
En Japón, además del Ninsho, también se utilizan las vías Todokede y Shonin para Dispositivos Médicos . Dependiendo de la categoría de riesgo del dispositivo y de la disponibilidad de predicados en Japón, el fabricante debe planificar cuidadosamente la presentación de su dispositivo.
¿Cuáles son los requisitos previos para la certificación Ninsho?
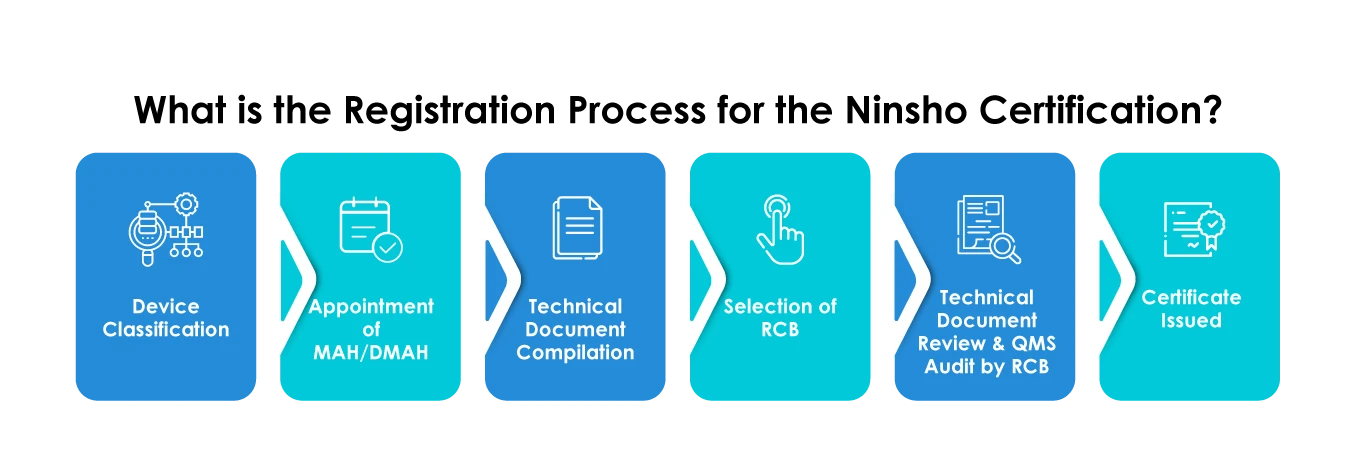
Los fabricantes que registren sus dispositivos a través de la vía Ninsho deben planificar meticulosamente las presentaciones en cuanto a lo siguiente:
- Selección de un RCB
- Envío de datos generales sobre el dispositivo, como Dispositivos Médicos , el uso previsto, los datos del análisis de riesgos y eficacia, los datos clínicos, etc.
- Proporcionar un resumen de la documentación técnica (STED)
- Los documentos deberán presentarse únicamente en japonés.
- Los fabricantes extranjeros deben designar obligatoriamente a un titular de la autorización de comercialización (TAC) o a un titular de la autorización de comercialización designado (TACD).
- Los fabricantes extranjeros deben registrarse en MHLW obtener un certificado de registro de fabricante extranjero (FMR) para sus establecimientos de fabricación.
¿Qué son los RCB?
Los organismos de certificación registrados (RCB) son organismos de certificación independientes acreditados por el MHLW. Los RCB se encargan de revisar y certificar los productos sanitarios que cumplen los requisitos y se solicitan en virtud de la vía Ninsho. Los RCB también se encargan de llevar a cabo la auditoría del sistema de gestión de calidad de las instalaciones del fabricante.
¿Cuáles son los requisitos del SGC para el registro de productos según la vía Ninsho?
Los fabricantes deben cumplir todos los requisitos del SGC definidos en la Ordenanza 169. El MAH o el DMAH deben presentar la solicitud a los RCB. Los ORC llevarán a cabo una inspección detallada del SGC en las instalaciones del fabricante y, si la aplicación del SGC es satisfactoria, expedirán el certificado.
¿Cuál es el plazo medio necesario para obtener el certificado Ninsho?
El OCR suele necesitar entre tres (03) y cinco (05) meses para completar la evaluación técnica, realizar la auditoría del SGC y expedir el certificado Ninsho.
¿Existe algún plazo de caducidad para la certificación Ninsho?
Dispositivos Médicos no caduca, pero el patrocinador debe renovar los certificados del sistema de gestión de calidad (SGC) cada cinco (05) años.
Japón, siendo el tercer mercado más grande para dispositivos médicos después de EE. UU. y China, ofrece grandes oportunidades para Dispositivos Médicos de todo el mundo. Los fabricantes que deseen comercializar sus dispositivos en Japón deben planificar cuidadosamente la Dispositivos Médicos y aprobación Dispositivos Médicos , ya que PMDA requisitos reglamentarios específicos. Los fabricantes pueden optar por un socio reglamentario confiable para acceder sin complicaciones al mercado japonés.
Para obtener más información sobre Dispositivos Médicos en Japón o cualquier otra normativa PMDA , póngase en contacto con Freyr hoy mismo.