Los productos sanitarios innovadores son esenciales para mejorar los resultados de la atención sanitaria, responder a las necesidades médicas cambiantes y ofrecer soluciones rentables a pacientes y profesionales sanitarios. La estrategia SAKIGAKE es un proceso acelerado de revisión y aprobación de productos sanitarios innovadores en Japón. Esta estrategia fue puesta en marcha por el Ministerio de Sanidad, Trabajo y Bienestar de JapónMHLW) en 2015, con el objetivo de acelerar el desarrollo y la comercialización de dispositivos médicos innovadores en Japón.
En virtud de la estrategia SAKIGAKE, los productos sanitarios que cumplen determinados criterios de innovación pueden recibir una revisión y aprobación prioritarias por parte de la Agencia de Productos Farmacéuticos y Dispositivos Médicos (PMDA), la agencia reguladora responsable de Dispositivos Médicos en Japón. Los criterios de designación para la innovación incluyen lo siguiente:
- Dispositivos con una eficacia destacada; se espera que el dispositivo proporcione un beneficio clínico significativo con un mecanismo de acción novedoso y una mejora radical a los pacientes en comparación con los dispositivos médicos existentes.
- En primer lugar, el dispositivo puede homologarse en Japón o simultáneamente en Japón y otros países.
- El dispositivo puede satisfacer necesidades médicas no cubiertas en Japón. La afección debe ser grave, potencialmente mortal o con síntomas persistentes.
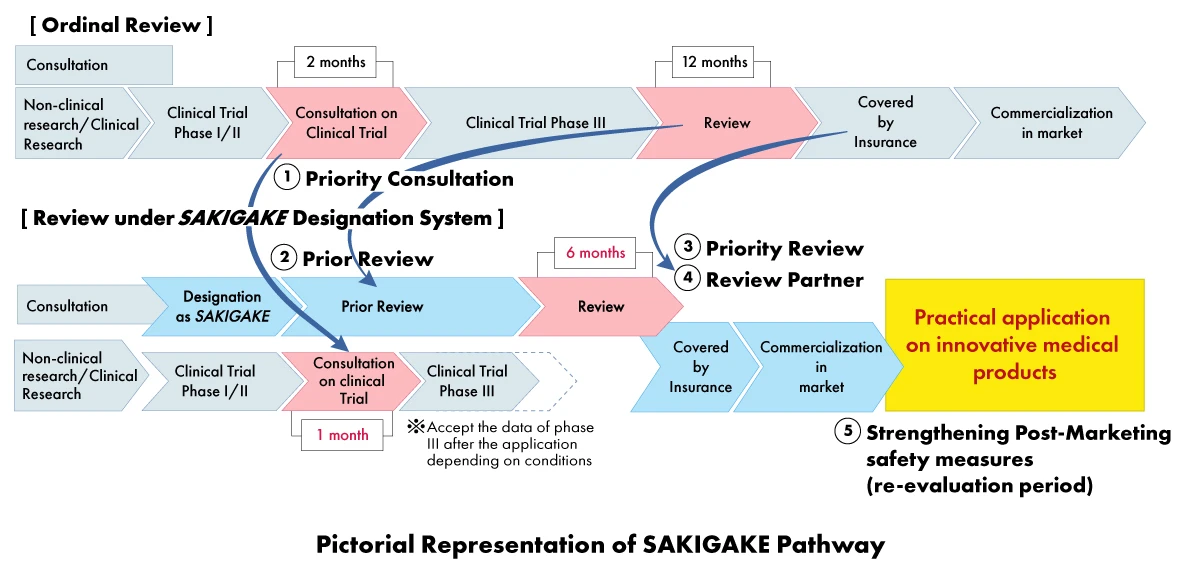
En el marco de la estrategia SAKIGAKE, Dispositivos Médicos pueden beneficiarse de una serie de ventajas, entre las que se incluyen:
- Consulta prioritaria: Reducción del tiempo de espera para la consulta de ensayos clínicos a un (01) mes.
- Revisión prioritaria: Los productos designados por SAKIGAKE reciben una revisión prioritaria, con el objetivo de completar el proceso de revisión en un plazo de seis (06) meses en lugar de 12 meses.
- Revisión efectiva antes de la solicitud: Fomentar la consulta y aceptar materiales en inglés.
- Socio de revisión dedicado: A cada producto designado por SAKIGAKE se le asigna un gestor de revisión dedicado para todo el proceso de aprobación.
- Refuerzo de las medidas de seguridad posteriores a la comercialización: Ampliación del periodo de reexamen y facilitación de la conexión con las sociedades científicas.
¿Cómo solicitarlo?
- Por el solicitante: El solicitante presenta la solicitud a la División de Evaluación y Concesión de Licencias (ELD) PMDA .
- Por PMDA: ELD se acerca a un posible candidato.
P.C- PMDA, Japón.
En general, el sistema SAKIGAKE proporciona una vía acelerada para el desarrollo y la aprobación de dispositivos médicos innovadores en Japón. Su objetivo es mejorar los resultados de los pacientes y promover la innovación en la Dispositivos Médicos . El fabricante debe consultar a PMDA del proceso de desarrollo para discutir los requisitos reglamentarios y recibir comentarios sobre sus planes de desarrollo de productos.
Para obtener más información sobre los procesos Dispositivos Médicos en Japón, reach con unexperto en normativaahora mismo. Manténgase informado. Cumpla con la normativa.