Shonin (Pre-Market Approval) es la vía regulatoria para el registro de productos sanitarios en Japón. La vía Shonin es principalmente para el registro de dispositivos médicos de clase II y III para los que no están disponibles las normas de clasificación de PMDA. Para los dispositivos de alto riesgo de Clase IV también, los fabricantes deben presentar la solicitud Shonin. La PMDA es responsable de la revisión y aprobación de la solicitud Shonin.
¿Cuáles son las otras vías de registro de productos en Japón?
Además de Shonin, las vías Todokede y Ninsho también se utilizan para Dispositivos Médicos en Japón. Dispositivos Médicos pueden elegir una de ellas en función de la clase de riesgo del dispositivo y la disponibilidad de predicados en Japón. El fabricante deberá identificar la clasificación del dispositivo e investigar la disponibilidad de la Norma Industrial Japonesa (JIS) antes de determinar la vía de registro aplicable.
- Todokede (Presentación previa a la comercialización) - Se aplica a los dispositivos de clase I y exige a los fabricantes presentar una notificación previa a la comercialización a la PMDA para su aprobación.
- Ninsho (Certificación previa a la comercialización) - Se aplica a los dispositivos genéricos de clase II y III que tienen normas de certificación (normas JIS). El organismo de certificación registrado (RCB) es responsable de la revisión y aprobación de la solicitud.
¿Cuáles son los requisitos previos para inscribirse en Shonin?
Los fabricantes que registren sus dispositivos a través de la vía Shonin deben planificar meticulosamente las presentaciones. Deben garantizar lo siguiente:
- Envío de datos generales sobre el dispositivo, como Dispositivos Médicos , el uso previsto, los datos del análisis de riesgos y eficacia, los datos clínicos, etc.
- Proporcionar un resumen de la documentación técnica (STED)
- Entrega de documentos sólo en japonés
- Los fabricantes extranjeros deben designar obligatoriamente a un Titular dela Autorización de Comercialización (TAC) o a un Titular de la Autorización de Comercialización Designado (TACD).
- Los fabricantes extranjeros deben obtener un certificado de Registro de Fabricante Extranjero (FMR) para sus establecimientos de fabricación.
¿Cuáles son los requisitos del SGC para el registro de productos por la vía Shonin?
Los fabricantes deben cumplir todos los requisitos del SGC definidos en la Ordenanza 169. El promotor o el DMAH o MAH deben presentar una solicitud a PMDA. La PMDA lleva a cabo una inspección detallada del SGC en las instalaciones del fabricante y expide el certificado tras la aplicación satisfactoria del SGC.
¿Cuál es el proceso de registro para la aprobación de dispositivos por la vía Shonin?
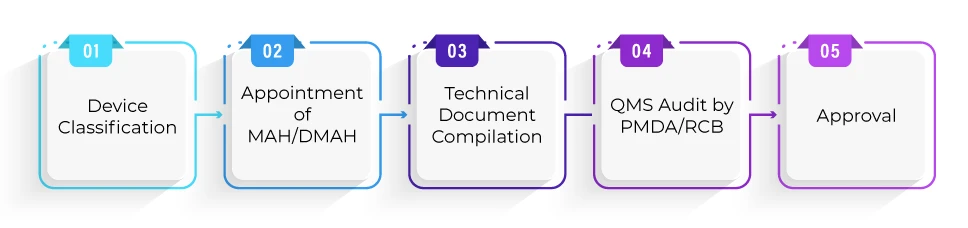
¿Cuál es el plazo medio necesario para la aprobación de un producto según la vía Shonin?
PMDA suele requerir 12 meses para la evaluación técnica a partir de la fecha de recepción de la solicitud Shonin. El fabricante debe tener en cuenta en los plazos de su proyecto el tiempo necesario para preparar los documentos de presentación o realizar estudios clínicos.
¿Existe algún plazo de caducidad para el registro de dispositivos por la vía Shonin?
Dispositivos Médicos no caduca, pero el patrocinador debe renovar los certificados del SGC cada cinco (05) años.
Japón es un mercado lucrativo, pero intrínsecamente presenta complejidades normativas y barreras lingüísticas. Los fabricantes deben tener en cuenta estos factores y planificar de forma proactiva su estrategia de comercialización (GTM) para Japón. Los fabricantes Dispositivos Médicos de diagnóstico in vitro pueden optar por externalizar todos los matices normativos a un socio normativo fiable y utilizar los recursos para centrarse en otros componentes esenciales.
Para obtener más información sobre Dispositivos Médicos Shonin Dispositivos Médicos en Japón o cualquier otra normativa PMDA , póngase en contacto hoy mismo con los expertos en normativade Freyr.