
L'interchangeabilité avec un produit biologique de référence est une étape cruciale dans le processus d'autorisation des biosimilaires. Elle garantit qu'un biosimilaire peut remplacer le produit de référence sans risque significatif de perte d'efficacité ou d'augmentation des problèmes de sécurité. Ce blog tente de comprendre les dernières FDA concernant les considérations relatives à l'interchangeabilité et les meilleures pratiques de l'industrie pour atteindre l'excellence réglementaire.
Définir l'interchangeabilité
Atteindre l'interchangeabilité est un processus complexe et rigoureux qui nécessite de répondre à des exigences réglementaires strictes. Le défi consiste à démontrer que le biosimilaire ne correspond pas seulement au produit de référence en termes de de sécurité et d'efficacité mais aussi qu'il donne les mêmes résultats cliniques chez un patient donné. Le non-respect de ces exigences peut entraîner des retards ou des refus d'approbation, ce qui affecte l'accès au marché et les soins aux patients.
Exigences réglementaires en matière d'interchangeabilité
La FDA des critères spécifiques pour démontrer l'interchangeabilité dans ses documents d'orientation. Ces critères comprennent :
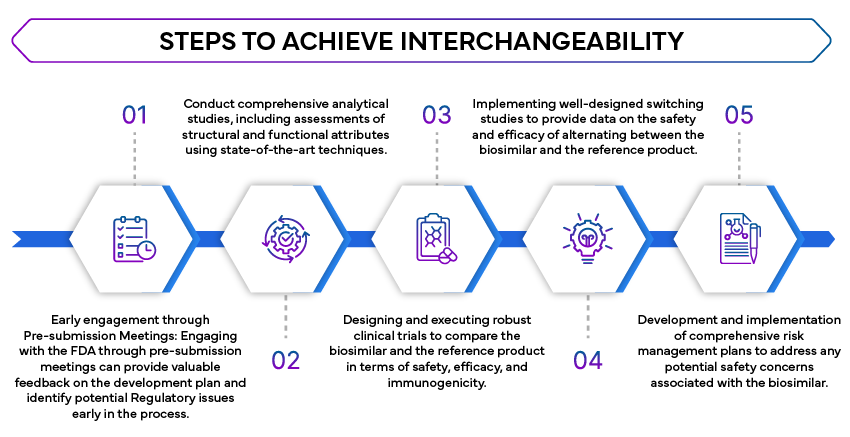
- Études analytiques comparatives : Des études analytiques approfondies sont nécessaires pour démontrer que le biosimilaire est hautement similaire au produit de référence. Ces études évaluent la structure moléculaire, la fonction et la composition du biosimilaire.
- Études cliniques : Des études cliniques sont nécessaires pour confirmer que le biosimilaire ne présente pas de différences cliniquement significatives par rapport au produit de référence en termes de sécurité, de pureté et d'activité. Cela implique souvent des études pharmacocinétiques (PK) et pharmacodynamiques (PD) comparatives.
- Études de substitution : La FDA des études de substitution afin d'évaluer l'impact de l'alternance entre le produit biosimilaire et le produit de référence. Ces études sont essentielles pour garantir que la substitution n'affecte pas l'efficacité ou la sécurité du traitement.
- Stratégies d'évaluation et d'atténuation des risques (REMS) : le cas échéant, les REMS doivent être abordées afin de garantir que le biosimilaire peut être utilisé de manière interchangeable sans problèmes de sécurité supplémentaires.
Étapes de la réalisation stratégique de l'interchangeabilité
Rôle d'un partenaire réglementaire
Les partenariats réglementaires peuvent améliorer considérablement les chances de parvenir à l'interchangeabilité. Voici comment un partenaire réglementaire peut vous aider :
- Conseils d'experts : fournit des conseils d'experts sur les exigences réglementaires et les stratégies à adopter pour respecter FDA .
- Soutien à la documentation : Aide à la préparation de documents de soumission de haute qualité conformes aux normes réglementaires.
- Conception d'études cliniques : Soutien à la conception et à l'exécution d'études cliniques robustes et d'études de commutation.
- Interactions avec l'AH : Facilite une communication efficace avec l'AH, en assurant un retour d'information constructif et en temps utile.
- Gestion des risques : Élaborer des stratégies globales de gestion des risques afin d'atténuer les problèmes de sécurité potentiels.
Avantages d'un partenaire réglementaire
| Avantages | Description | |
| 1. | Expertise en matière d'exigences réglementaires | Compréhension approfondie de l'environnement et des exigences réglementaires au niveau mondial. |
| 2. | Documentation simplifiée | Veiller à la préparation d'une documentation précise et conforme. |
| 3. | Processus de soumission efficace | Réduit les délais et les coûts grâce à une gestion efficace des soumissions. |
| 4. | Conformité renforcée | Minimise les risques de retards et de rejets grâce à une mise en conformité rigoureuse. |
| 5. | Gestion efficace des risques | Identification et atténuation proactives des risques potentiels. |
Résumé
Atteindre l'interchangeabilité avec un produit de référence est un processus exigeant mais essentiel pour l'approbation réussie des biosimilaires. Il nécessite une compréhension approfondie des exigences réglementaires, une planification méticuleuse et des données cliniques solides. Un partenariat avec un prestataire de services réglementaires expérimenté peut considérablement augmenter les chances de succès, en garantissant que le biosimilaire répond aux critères rigoureux fixés par les autorités réglementaires. En s'appuyant sur des conseils d'experts, une documentation complète et une gestion stratégique des risques, les promoteurs peuvent naviguer plus efficacement sur la voie complexe de l'interchangeabilité.









