
Avec la mise en œuvre par US and Drug Administration (USFDA) de la règle finale relative aux réglementations sur les systèmes de gestion de la qualité (QMSR) en 2024, les fabricants de dispositifs médicaux doivent adopter les modifications afin de commercialiser et distribuer leurs dispositifs sur le marché américain.
Cette règle met à jour les réglementations du système qualité (QSR) USFDAen s'alignant sur la ISO 13485:2016, qui est la norme internationale pour les systèmes de gestion de la qualité des dispositifs médicaux. Les fabricants de dispositifs médicaux disposent d'une période de transition de deux ans pour se conformer, ce qui oblige les organisations à s'adapter aux nouvelles exigences afin d'éviter toute non-conformité au moment de l'inspection.
Qu'est-ce que QMSR ?
FDA est une approche simplifiée des exigences du SMQ, qui constitue une mise à jour de l'ancienne structure QSR. Cet alignement est crucial car il simplifie la conformité mondiale pour les fabricants, en particulier ceux qui opèrent à l'échelle internationale. Cette harmonisation permettra aux entreprises de répondre aux exigences réglementaires tant aux US sur d'autres marchés de manière beaucoup plus uniforme.
Le QMSR impose des améliorations en matière de gestion des risques, de conception des dispositifs et de surveillance après commercialisation. Ce rôle peut ajouter à la complexité, mais il permet également aux fabricants de normaliser leurs procédures de qualité, ce qui renforce la sécurité des dispositifs et améliore la documentation, ce qui peut s'avérer essentiel lors USFDA .
Principaux changements dans le QMSR
- Harmonisation avec ISO 13485: Il s'agit de l'étape la plus importante qui permet aux fabricants de dispositifs médicaux d'accepter les normes internationalement reconnues. La USFDA que de nombreuses entreprises de dispositifs médicaux se conformaient déjà à ISO 13485, ce qui réduit les efforts redondants.
- La gestion des risques met l'accent sur la gestion des risques tout au long du cycle de vie du dispositif médical. Les fabricants de dispositifs médicaux doivent faire preuve d'une gestion des risques, d'un contrôle des risques et d'une gestion des risques efficaces.
- Conception et contrôles des dispositifs : dans le cadre du QMSR, les contrôles de conception ont été étendus afin de garantir que les fabricants de dispositifs médicaux tiennent pleinement compte des besoins des utilisateurs, de la sécurité des dispositifs et des critères de performance, qui constituent un domaine prioritaire lors USFDA .
- Surveillance post-marché : Les entreprises doivent améliorer le système de surveillance après la mise sur le marché. Cela permettra aux fabricants de recueillir des informations sur la sécurité et l'efficacité des dispositifs, ce qui contribuera à la détection rapide des problèmes et à leur identification rapide.
- Documentation et tenue de registres : Il s'agit de la règle finale qui met l'accent sur la documentation. La tenue d'un registre complet et adéquat est essentielle lors de l'inspection.
Étapes à suivre pour se préparer à l'inspection de la US and Drug Administration US :
L'inspection devant durer jusqu'en 2026, les entreprises disposent de deux ans pour mettre en place leurs systèmes de qualité, qui s'alignent sur les QMSR. Toutefois, il peut être risqué d'attendre la dernière minute.
Étapes de USFDA dans le cadre du QMSR pour les industries dont le système de gestion de la qualité actuel n'est pas basé sur le QSR :
- Effectuer une analyse des lacunes : Il s'agit de la première étape lorsque le système de qualité actuel diverge des nouvelles exigences du RGQ. Une analyse complète des lacunes permettra d'identifier les domaines nécessitant des mises à jour, tels que la gestion des risques, la surveillance post-commercialisation et les contrôles de conception.
- Mettre à jour la procédure de gestion des risques : Veillez à ce que les activités de gestion des risques soient associées à l'ensemble du cycle de vie de votre produit, de la conception à la surveillance post-commercialisation.
- Revoir le contrôle de la conception : Les fabricants doivent s'assurer que le processus de conception est solide et bien documenté. Validez que le processus de conception est solide et bien documenté et qu'il est pleinement intégré dans votre système de gestion de la qualité.
- Renforcer la surveillance après la mise sur le marché : Mettre en place des systèmes de suivi des performances des dispositifs après leur mise sur le marché. Il peut s'agir de mettre en place des mécanismes de retour d'information de la part des clients, de recueillir des données cliniques et de les suivre de près.
- Formation et documentation : Former le personnel aux nouvelles exigences, en particulier les personnes impliquées dans la gestion de la qualité et la conformité réglementaire. Cela permet de garantir que tous les processus de documentation sont conformes aux attentes du QMSR.
- Certification par un organisme tiers : si votre entreprise n'est pas ISO 13485 , le moment est peut-être venu d'y songer. L'obtention ISO 13485 peut vous donner une longueur d'avance pour répondre aux exigences de USFDA renforcer votre crédibilité sur les marchés mondiaux.
Naviguer dans la période de transition de deux ans
Pour tirer pleinement parti de la période de transition et garantir la conformité avec la réglementation relative au système de gestion de la qualité (QMSR) USFDA, les fabricants doivent adopter une approche proactive. Voici une feuille de route suggérée :
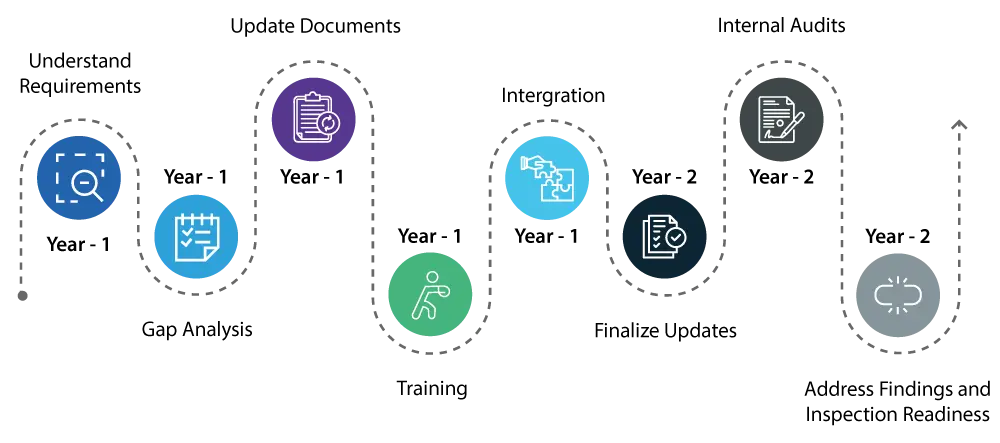
Année 1 :
- Comprendre l'exigence : Commencez par bien comprendre les changements introduits par le QMSR. Cela implique un examen détaillé des nouvelles exigences et de la manière dont elles diffèrent du règlement existant sur le système de qualité (QS).
- Connaître les lacunes : procédez à une analyse complète des lacunes afin d'identifier les domaines de votre système de qualité actuel qui nécessitent des mises à jour pour répondre aux nouvelles normes QMSR.
- Mise à jour des documents / remédiation : initiez les mises à jour nécessaires de votre système de qualité, en vous concentrant sur des domaines tels que la gestion des risques et les contrôles de conception, qui sont des éléments essentiels du QMSR.
- Formation :Commencez à former votre personnel aux nouvelles réglementations afin de vous assurer que toutes les personnes concernées sont conscientes des changements et comprennent leur rôle dans le maintien de la conformité.
- Intégration : commencez à intégrer les nouvelles exigences du RGQ dans vos activités quotidiennes afin de faciliter la transition.
Année 2 :
- Poursuivre la mise en œuvre des changements apportés à votre système de qualité, en veillant à ce que toutes les mises à jour soient pleinement intégrées et opérationnelles.
- Mener des audits internes approfondis pour vérifier que les mises à jour sont effectives et que votre système de qualité est entièrement aligné sur les exigences du RGQ.
- Traitez rapidement les conclusions des audits internes afin de garantir la conformité de tous les aspects de votre système de qualité.
- À la fin de la deuxième année, votre système qualité devrait être entièrement conforme au QMSR, et vous devriez être prêt pour USFDA avec l'assurance qu'il n'y aura pas de problèmes majeurs.
En suivant cette feuille de route, les fabricants peuvent non seulement satisfaire aux exigences USFDA, mais également mettre en place un système qualité robuste, efficace, normalisé et reconnu à l'échelle mondiale. Cette approche proactive contribuera à assurer une transition en douceur vers les nouvelles réglementations et à maintenir les normes les plus élevées en matière de qualité et de sécurité des dispositifs médicaux.
Conclusion : Prendre des mesures proactives
Se préparer aux USFDA dans le cadre de la nouvelle règle QMSR ne consiste pas seulement à éviter des sanctions, mais aussi à améliorer la sécurité et l'efficacité des dispositifs. En s'harmonisant avec ISO 13485, USFDA des attentes plus élevées, mais offre également une voie vers une conformité mondiale plus rationalisée. Les fabricants qui commencent à s'adapter tôt doivent se concentrer sur des domaines clés tels que la gestion des risques et la surveillance après commercialisation, et s'assurer que leurs systèmes qualité sont à jour et robustes, ce qui leur permettra non seulement de répondre aux attentes réglementaires, mais aussi de renforcer leur avantage concurrentiel sur le marché.
