
La gestion des modifications post-approbation est un aspect essentiel, mais souvent négligé, de la gestion du cycle de vie des produits pharmaceutiques. Une fois qu'un produit pharmaceutique a été approuvé, il doit continuer à répondre aux normes réglementaires afin de garantir sa sécurité, son efficacité et sa qualité. Cela implique d'apporter les modifications nécessaires au produit, à son processus de fabrication ou à son emballage.
Ces changements vont souvent de l'amélioration de l'efficacité de la production à la résolution des problèmes de sécurité, en passant par la mise en conformité avec les dernières et/ou nouvelles exigences réglementaires. Cependant, la gestion de ces changements présente plusieurs défis cachés qui peuvent avoir un impact sur le cycle de vie du produit et sur sa présence sur le marché. Dans une telle entreprise, la présence d'un partenaire réglementaire est nécessaire pour assurer la gestion de ce processus de changement et conduire les opérations réglementaires en douceur.
Obstacles pour une entreprise pharmaceutique
La gestion des modifications post-approbation est complexe et varie d'une région à l'autre, ce qui crée des obstacles en matière de conformité. En outre, garantir l'intégrité des données, coordonner les différentes parties prenanteset la gestion d'une documentation abondante peut s'avérer décourageant. L'incapacité à gérer efficacement ces aspects peut entraîner une non-conformité réglementaire, des rappels de produits et de graves atteintes à la réputation et aux opérations.
Quelques défis à relever en matière de gestion des changements post-approbation
- Complexité réglementaire
- Les différentes autorités sanitaires (AP) dans le monde ont des exigences uniques en matière de modifications post-approbation qui nécessitent une compréhension approfondie des lignes directrices et des délais spécifiques à chaque région. Il est essentiel de comprendre ces différences pour que les demandes d'homologation soient déposées dans les délais et avec succès.
- Les retards dans la compréhension de ces réglementations peuvent entraîner des revers importants dans le cycle de vie du produit.
- Intégrité des données
- Il est primordial de garantir l'exactitude et l'intégrité des données soumises pour les modifications post-approbation. Des données inexactes ou incomplètes peuvent entraîner des rejets de la réglementation et des retards importants.
- Le maintien de normes de qualité élevées pour les données implique des processus de validation rigoureux et des audits fréquents pour éviter les divergences.
- Coordination des parties prenantes
- Une gestion efficace des changements post-approbation implique une coordination entre les équipes internes (telles que la R&D, la fabrication et l'assurance qualité) et les partenaires externes (tels que les organisations de fabrication sous contrat).
- L'utilisation d'outils de gestion de projet et la tenue régulière de réunions interfonctionnelles peuvent améliorer la collaboration et garantir l'alignement de toutes les parties.
- Documentation
- Une documentation détaillée et précise est essentielle pour démontrer la conformité et faciliter les processus d'examen.
- Au contraire, de mauvaises pratiques en matière de documentation peuvent entraîner des demandes de renseignements réglementaires, des demandes de données supplémentaires et des retards dans la soumission.
- Gestion des risques
- La gestion proactive des risques permet d'anticiper les défis et de mettre en œuvre des solutions pour maintenir le processus de soumission sur la bonne voie.
- Un plan de gestion des risques efficace réduit la probabilité d'un échec de la réglementation et garantit une conformité permanente.
Rôle de l'expert en réglementation
Les experts en réglementation jouent un rôle important dans la résolution de ces problèmes en fournissant une expertise et un soutien spécialisés :
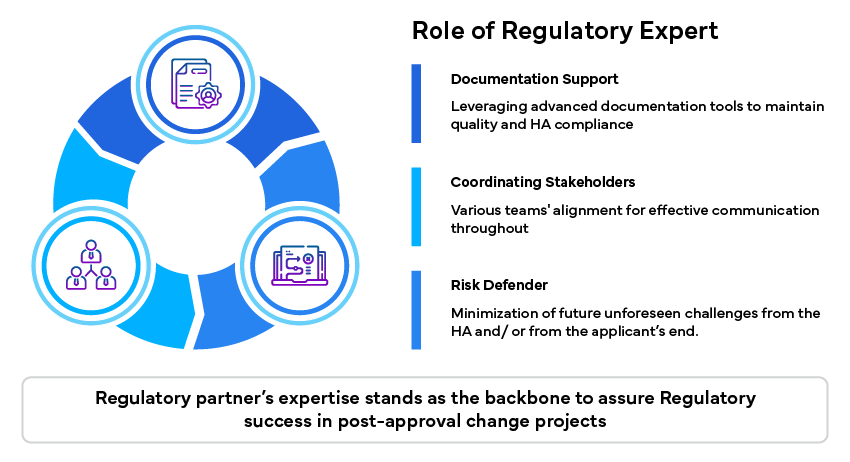
Résumé
Une gestion efficace des changements post-approbation est essentielle pour maintenir la qualité, la sécurité et l'efficacité des produits pharmaceutiques. Pour obtenir l'approbation de l'AP en matière de gestion des changements, il est nécessaire de naviguer dans les méandres de la réglementation. Les experts en réglementation apportent un soutien inestimable pour surmonter ces défis en offrant leur expertise, en facilitant la coordination et en atténuant les risques. En tirant parti de leurs capacités, les demandeurs peuvent garantir une gestion réussie des changements après approbation et maintenir la présence de leurs produits sur le marché.









