
Wraz z wdrożeniem przez US Agencję US i Leków (USFDA) ostatecznych przepisów dotyczących systemu zarządzania jakością (QMSR) w 2024 r., producenci urządzeń medycznych muszą dostosować się do zmian, aby móc wprowadzać swoje produkty na rynek amerykański i dystrybuować je w Stanach Zjednoczonych.
Zasada ta aktualizuje przepisy USFDAsystemu jakości (QSR) poprzez dostosowanie ich do normy ISO 13485:2016, która jest międzynarodową normą dotyczącą systemu zarządzania jakością wyrobów medycznych. Producenci wyrobów medycznych mają dwa lata na dostosowanie się do nowych wymogów, co oznacza, że organizacje muszą je wdrożyć, aby uniknąć niezgodności w momencie kontroli.
Czym jest QMSR?
FDA to uproszczone podejście do wymagań QMS, które stanowi aktualizację poprzedniej struktury QSR. Dostosowanie to ma kluczowe znaczenie, ponieważ upraszcza globalną zgodność dla producentów, zwłaszcza tych, którzy prowadzą działalność na całym świecie. Harmonizacja ta pozwoli firmom spełniać wymagania regulacyjne zarówno w US na innych rynkach w znacznie bardziej ujednolicony sposób.
QMSR nakłada obowiązek wprowadzenia ulepszeń w zakresie zarządzania ryzykiem, projektowania urządzeń i nadzoru po wprowadzeniu do obrotu. Może to zwiększyć złożoność procesu, ale jednocześnie umożliwia producentom standaryzację procedur jakościowych, co z kolei podnosi bezpieczeństwo urządzeń i poprawia dokumentację, co może mieć kluczowe znaczenie podczas USFDA .
Kluczowe zmiany w QMSR
- Harmonizacja z ISO 13485: Jest to najważniejszy krok, który pozwala producentom wyrobów medycznych na przyjęcie międzynarodowych standardów. USFDA , że wiele wyroby medyczne już spełnia wymagania ISO 13485, co ogranicza powielanie działań.
- Risk Management kładzie nacisk na zarządzanie ryzykiem w całym cyklu życia urządzenia medycznego. Producenci urządzeń medycznych muszą wykazywać się skutecznym zarządzaniem ryzykiem, kontrolą ryzyka i zarządzaniem ryzykiem.
- Projektowanie urządzeń i kontrole: W ramach QMSR rozszerzono zakres kontroli projektowania, aby zapewnić, że producenci urządzeń medycznych w pełni uwzględniają potrzeby użytkowników, bezpieczeństwo urządzeń i kryteria wydajności, co stanowi obszar szczególnego zainteresowania podczas USFDA .
- Nadzór pozarynkowy: Firmy muszą usprawnić system monitorowania po wprowadzeniu produktu na rynek. Dzięki temu producenci będą mogli gromadzić informacje na temat bezpieczeństwa i skuteczności urządzeń, co pomoże w szybkim wykrywaniu i identyfikowaniu problemów.
- Dokumentacja i prowadzenie rejestrów: Jest to ostateczna zasada, która kładzie nacisk na dokumentację. Dokładne / prawidłowe prowadzenie dokumentacji ma kluczowe znaczenie podczas inspekcji.
Kroki przygotowujące do kontroli przeprowadzanej przez US Agencję US i Leków (FDA):
Ponieważ inspekcja potrwa do 2026 r., firmy mają dwa lata na dostosowanie swoich systemów jakości do QMSR. Jednak czekanie na ostatnią chwilę może być ryzykowne.
Kroki USFDA w ramach QMSR dla branż, w których obecny system zarządzania jakością nie jest oparty na QSR:
- Przeprowadzenie analizy luk: Jest to pierwszy krok, w którym obecny system jakości odbiega od nowych wymagań QMSR. Przeprowadzona analiza luk pomoże zidentyfikować obszary wymagające aktualizacji, takie jak zarządzanie ryzykiem, nadzór po wprowadzeniu na rynek i kontrole projektu.
- Aktualizacja procedury zarządzania ryzykiem: Upewnij się, że działania związane z zarządzaniem ryzykiem są połączone z całym cyklem życia produktu, od projektu do nadzoru po wprowadzeniu na rynek.
- Rewizja kontroli projektu: Producenci powinni upewnić się, że proces projektowania jest solidny i dobrze udokumentowany. Należy sprawdzić, czy proces projektowania jest solidny i dobrze udokumentowany oraz w pełni zintegrowany z systemem zarządzania jakością.
- Wzmocnienie nadzoru po wprowadzeniu na rynek: Wdrożenie systemów monitorowania działania urządzenia po jego wprowadzeniu na rynek. Może to obejmować ustanowienie mechanizmów informacji zwrotnej od klientów, gromadzenie danych klinicznych i ich dokładne śledzenie.
- Szkolenia i dokumentacja: Przeprowadzenie szkoleń dla pracowników w zakresie nowych wymagań, zwłaszcza tych, którzy zajmują się zarządzaniem jakością i zgodnością z przepisami. Dzięki temu wszystkie procesy dokumentacyjne będą zgodne z oczekiwaniami QMSR.
- Certyfikacja przez stronę trzecią: Jeśli Twoja firma nie posiada ISO 13485 , być może nadszedł czas, aby to rozważyć. Uzyskanie ISO 13485 może zapewnić Ci przewagę w spełnianiu wymagań amerykańskiej USFDA wiarygodność na rynkach światowych.
Poruszanie się po dwuletnim okresie przejściowym
Aby efektywnie wykorzystać okres przejściowy i zapewnić zgodność z przepisami USFDA dotyczącymi systemu zarządzania jakością (QMSR), producenci powinni przyjąć proaktywne podejście. Oto sugerowany plan działania:
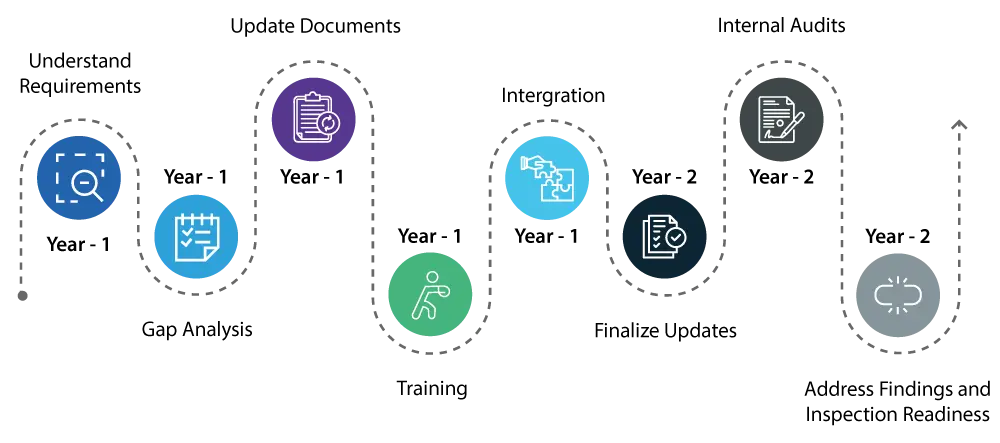
Rok 1:
- Zrozumienie wymagań: Zacznij od dokładnego zrozumienia zmian wprowadzonych przez QMSR. Obejmuje to szczegółowy przegląd nowych wymagań i ich różnic w stosunku do istniejącego rozporządzenia w sprawie systemu jakości (QS).
- Poznaj luki: Przeprowadź kompleksową analizę luk, aby zidentyfikować obszary w obecnym systemie jakości, które wymagają aktualizacji w celu spełnienia nowych standardów QMSR.
- Aktualizacja dokumentów / działania naprawcze: Zainicjuj niezbędne aktualizacje systemu jakości, koncentrując się na obszarach takich jak zarządzanie ryzykiem i kontrole projektu, które są kluczowymi elementami QMSR.
- Szkolenie: Rozpocznij szkolenie pracowników w zakresie nowych przepisów, aby upewnić się, że wszyscy zaangażowani są świadomi zmian i rozumieją swoje role w utrzymaniu zgodności.
- Integracja: Rozpocznij integrację nowych wymagań QMSR z codziennymi operacjami, aby ułatwić przejście.
Rok 2:
- Kontynuuj wdrażanie zmian w systemie jakości, upewniając się, że wszystkie aktualizacje są w pełni zintegrowane i operacyjne.
- Przeprowadź dokładne audyty wewnętrzne, aby sprawdzić, czy aktualizacje są skuteczne i czy system jakości jest w pełni zgodny z wymogami QMSR.
- Należy niezwłocznie zająć się wszelkimi ustaleniami z audytów wewnętrznych, aby zapewnić zgodność wszystkich aspektów systemu jakości.
- Pod koniec drugiego roku system jakości powinien być w pełni zgodny z QMSR, a firma powinna być przygotowana do USFDA , mając pewność, że nie pojawią się żadne poważne problemy.
Postępując zgodnie z tym planem działania, producenci mogą nie tylko spełnić wymagania USFDA, ale także stworzyć solidny system jakości, który jest wydajny, znormalizowany i uznawany na całym świecie. Takie proaktywne podejście pomoże zapewnić płynne przejście na nowe przepisy i utrzymać najwyższe standardy jakości i bezpieczeństwa wyroby medyczne.
Podsumowanie: Podejmowanie proaktywnych kroków
Przygotowanie do USFDA zgodnie z nową zasadą QMSR nie polega wyłącznie na uniknięciu kar — chodzi o poprawę bezpieczeństwa i skuteczności urządzeń. Dzięki harmonizacji z ISO 13485 USFDA wyższe wymagania, ale jednocześnie zapewnia ścieżkę do bardziej usprawnionej globalnej zgodności. Producenci, którzy wcześnie zaczną dostosowywać się do nowych przepisów, powinni skupić się na kluczowych obszarach, takich jak zarządzanie ryzykiem i nadzór po wprowadzeniu produktu do obrotu, oraz zadbać o to, aby ich systemy jakości były aktualne i solidne, co nie tylko pozwoli spełnić oczekiwania organów regulacyjnych, ale także zwiększy ich przewagę konkurencyjną na rynku.
